Lei de Boyle
A lei de Boyle (também chamada lei de Mariotte e lei de Boyle-Mariotte) é uma lei sobre gases ideais.
A lei pode ser declarada da seguinte forma:
Para uma quantidade fixa de um gás ideal mantido a uma temperatura fixa, P (pressão) e V (volume) são inversamente proporcionais.
Por outras palavras, o volume de uma massa constante de gás ideal a uma temperatura constante é inversamente proporcional à pressão aplicada sobre a mesma.
Nos símbolos, a lei é:
P ∝ 1 V {\i1}displaystyle P\i1 {\i1}{\i1}displaystyle P\i1 {\i1}frac
ou
P V = k {\displaystyle PV=k}
onde P é a pressão do gás, V é o volume do gás, e k é uma constante.
Para uma dada massa de gás a uma temperatura constante, o produto da pressão e do volume é uma constante. À medida que o volume diminui, a pressão aumenta em proporção, e vice-versa. Por exemplo, quando a pressão se reduz para metade, o volume duplica.
Suponha que tem um tanque que contém um certo volume de gás a uma certa pressão. Quando se diminui o volume do tanque, o mesmo número de partículas de gás está agora contido num espaço menor. Portanto, o número de colisões aumenta. Portanto, a pressão é maior.
Imagine que tem um gás a uma certa pressão (P1) e volume (V1). Se alterar a pressão para um novo valor (P2), o volume muda para um novo valor (V2). Podemos utilizar a lei de Boyle para descrever ambos os conjuntos de condições:
P 1 V 1 = k {\\i1}v_{\i}=k}
P 2 V 2 = k {\\i1}k}= k {\i1}displaystyle P_{2}V_{2}=k
A constante, k, é a mesma em ambos os casos, pelo que podemos dizer o seguinte:
P 1 V 1 = P 2 V 2 {\displaystyle P_{1}V_{1}=P_{2}V_{2}}}
Exemplo: A pressão de um gás é de 3 atm e o volume é de 5 litros. Se a pressão for reduzida para 2 atm, qual é o volume?
P 1 V 1 = P 2 V 2 {\displaystyle P_{1}V_{1}=P_{2}V_{2}}}
V 2 = P 1 V 1 P 2 {\displaystyle V_{2}={\frac {P_{1}V_{1}}{P_{2}}}}
V 2 = 3 ∗ 5 2 {\\i1}{\i1}={\i1}{\i1}{\i1}}V 2 = 3 ∗ 5 2
V 2 = 15 2 {\i1}{\i1}={\i1}{\i1}}V 2 = 15 2 {\i}displaystyle V_{\i}={\i1}frac
V 2 = 7,5 {\\\i1}=7,5 {\i1}displaystyle V_{\i}=7,5
∴ O volume será de 7,5 litros.
A lei foi encontrada por Robert Boyle em 1662, e depois independentemente por Edme Mariotte em 1679.
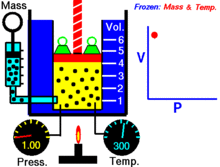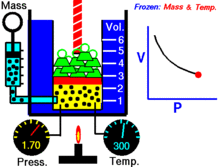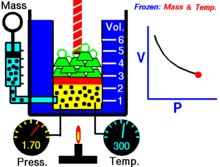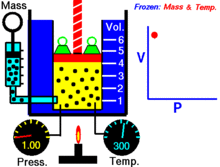
Uma animação mostrando a relação entre pressão e volume. A quantidade e temperatura do gás são constantes.
Perguntas e Respostas
P: Qual é a lei de Boyle?
R: A lei de Boyle (também chamada lei de Mariotte e lei de Boyle-Mariotte) é uma lei sobre gases ideais que diz que para uma quantidade fixa de um gás ideal mantido a uma temperatura constante, a pressão (P) e o volume (V) são inversamente proporcionais.
P: Como podemos expressar matematicamente a Lei de Boyle?
R: Podemos expressar a Lei de Boyle matematicamente como P ∝ 1/V ou PV = k, onde P é a pressão do gás, V é o volume do gás, e k é uma constante.
P: Quem descobriu essa lei?
R: A lei foi encontrada por Robert Boyle em 1662, e depois independentemente por Edme Mariotte em 1679.
P: O que significa quando dizemos que P e V são inversamente proporcionais?
R: Isso significa que à medida que um aumenta, o outro diminui proporcionalmente - portanto, se o senhor diminui o volume de um tanque contendo uma certa quantidade de gás a uma certa pressão, então, devido ao aumento das colisões entre partículas resultantes de estar contido em menos espaço, a pressão aumentará.
P: Como usamos a Lei de Boyle para calcular mudanças na pressão ou no volume?
R: Podemos usar a Lei de Boyle para calcular mudanças tanto na pressão quanto no volume usando duas equações - P1V1=k e P2V2=k - onde k permanece constante enquanto ou P1/V1 ou P2/V2 mudam, dependendo do que o senhor está tentando calcular.
P: Podemos aplicar esta lei também aos gases reais?
R: Não - isso só se aplica aos gases ideais, uma vez que eles não têm forças intermoleculares entre eles.
Pesquise na enciclopédia








