Estado de transição
Em uma reação química, o estado de transição é o ponto onde há um valor máximo de energia. Esta energia é chamada de energia de ativação. Quando duas ou mais moléculas são misturadas, elas se tocam uma na outra. Se elas atingirem com energia suficiente para passar pelo estado de transição, elas reagirão e formarão novas moléculas. No estado de transição, novos laços são formados enquanto os antigos são quebrados. Em um gráfico ou desenho, o estado de transição é freqüentemente marcado com o símbolo da adaga dupla ‡.
É muito difícil estudar um estado de transição. Isto porque é tão alto em energia que as moléculas permanecerão nessa forma por um tempo muito curto, geralmente em femtossegundos. É importante não confundir os estados de transição com os intermediários. Os intermediários são encontrados em pontos mínimos de energia e podem viver por um tempo muito longo. Como um estado de transição, porém, um intermediário está entre os reagentes e os produtos de uma reação.
O estudo dos estados de transição é muito importante para compreender os mecanismos de reação. Há teorias e programas de computador que podem ser usados para calcular como se parece o estado de transição. Isto é uma parte da cinética química.
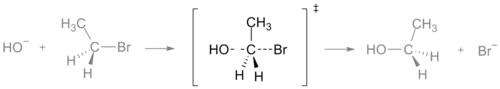
O estado de transição de uma reação SN2
Perguntas e Respostas
P: O que é o estado de transição em uma reação química?
R: O estado de transição é o ponto em que há um valor máximo de energia em uma reação química.
P: O que é a energia de ativação em uma reação química?
R: A energia necessária para que uma reação ocorra é chamada de energia de ativação.
P: O que acontece quando duas ou mais moléculas são misturadas em uma reação química?
R: Quando duas ou mais moléculas são misturadas, elas se chocam umas com as outras. Se baterem com energia suficiente para passar pelo estado de transição, elas reagirão e formarão novas moléculas.
P: Para que serve o símbolo do punhal duplo (‡) em um gráfico ou desenho de uma reação química?
R: O símbolo do punhal duplo (‡) é usado para marcar o estado de transição em um gráfico ou desenho de uma reação química.
P: Por que é difícil estudar o estado de transição em uma reação química?
R: É muito difícil estudar o estado de transição em uma reação química porque sua energia é tão alta que as moléculas permanecerão nessa forma por um período muito curto, geralmente femtossegundos.
P: O que é um intermediário em uma reação química?
R: Um intermediário é uma molécula que se encontra em pontos mínimos de energia em uma reação química e pode viver por um período muito longo.
P: Por que estudar os estados de transição é importante para entender os mecanismos de reação?
R: O estudo dos estados de transição é importante para a compreensão dos mecanismos de reação porque ajuda a determinar como uma reação ocorre e como controlá-la ou manipulá-la.
Pesquise na enciclopédia