Modelo de pudim de ameixa
O modelo do pudim de ameixa era um modelo do início (e incorreto) do século 20 de um átomo. Ele foi proposto por J.J. Thomson em 1904, após a descoberta do elétron, mas antes da descoberta do núcleo atômico. Durante esse tempo, os cientistas sabiam que havia uma carga positiva no átomo que equilibrava as cargas negativas dos elétrons, tornando o átomo neutro, mas não sabiam de onde vinha a carga positiva. O modelo de Thomson mostrava um átomo que tinha um meio com carga positiva, ou espaço, com elétrons carregados negativamente dentro do meio. Logo após sua proposta, o modelo foi chamado de modelo "pudim de ameixa" porque o meio positivo era como um pudim, com elétrons, ou ameixas, no interior.

Exemplo do modelo da Thomson
Desenvolvimento de um modelo atômico moderno
O modelo de Rutherford
Basicamente, em 1909, não muito depois que o modelo da Thomson foi proposto, Hans Geiger e Ernest Marsden fizeram uma experiência com chapas finas de ouro, para testar o modelo da Thomson. Seu professor, Ernest Rutherford, esperava que os resultados provassem que Thomson estava correto, mas seus resultados eram extremamente diferentes do que eles estavam esperando. Em 1911, Rutherford descobriu que as cargas positivas provinham de pequenas partículas chamadas prótons, e que os prótons estavam em um pequeno centro chamado núcleo, e que os elétrons estavam orbitando ao redor do núcleo.
Modelo Bohr
O modelo de Rutherford era bastante simples, mas estava errado porque os elétrons têm carga, e eles deveriam ser atraídos para o núcleo positivamente carregado. Em 1913, Niels Bohr acrescentou "níveis de energia" ao modelo atômico. Os elétrons não caem no núcleo porque estão contidos em níveis de energia, e para mudar para níveis de energia mais altos é necessária energia extra, e para mudar para níveis de energia mais baixos é necessária uma liberação de energia. Não é possível mudar os estados energéticos sem mudar a energia do elétron. Se um elétron for atingido por um fóton (uma partícula que carrega radiação eletromagnética) ele ganhará energia extra e passará para um nível de energia mais alto (ele muda de estado), então ele saltará de volta para um nível de energia mais baixo, liberando sua energia contida. Este novo modelo foi chamado de modelo Bohr ou modelo Rutherford-Bohr. Isto acrescentou todo um novo ramo da ciência: A física quântica.
Modelo Quantum
Em 1926 Erwin Schrödinger usou a idéia de que os elétrons atuavam como uma onda, assim como uma partícula, isto é conhecido como uma dualidade onda-partícula. Isto acrescentou uma camada totalmente nova ao modelo atômico e à física quântica. Com uma partícula, você pode saber onde ela está no espaço, se observar (olhar) para ela. Mas com uma onda, ela está em todo o lugar, então você não pode definir exatamente onde ela está. Isto é conhecido como incerteza quântica. Com um elétron, você só pode saber a probabilidade de ele estar em um lugar, porque é uma onda, bem como uma partícula. (Ver diagrama acima)
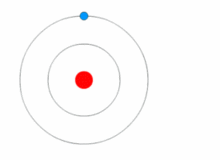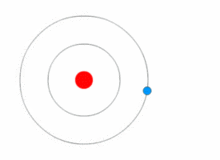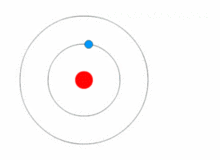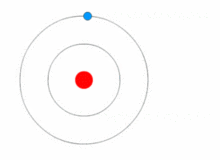
Uma imagem mostrando um nível de energia que muda de elétron, e ganhando e liberando energia como fótons.
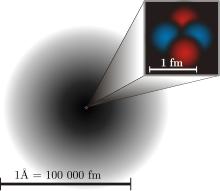
Isto mostra o modelo atômico atual. O sombreamento preto em torno do átomo mostra a probabilidade de encontrar um elétron ali. Quanto mais escuro for, mais chances você encontrará um elétron naquele local.
Páginas relacionadas
Pesquise na enciclopédia