Mecânica quântica
A Mecânica Quântica ou QM, descreve como o Universo funciona no nível menor que os átomos. Também é chamada de "física quântica" ou "teoria quântica". Quantum é a palavra latina para "quanto", e mecânica é a área da ciência preocupada com o movimento. Um quantum de energia é uma quantidade específica de energia, e a Mecânica Quântica descreve como essa energia se move e interage no nível subatômico.
Os átomos costumavam ser considerados os menores blocos de construção de matéria, mas a ciência moderna mostrou que existem partículas ainda menores, como prótons, nêutrons e elétrons. QM é a parte da física que descreve como funcionam as partículas que compõem os átomos.
A QM também nos diz como funcionam as ondas eletromagnéticas (como a luz). Grande parte da física e da química modernas podem ser descritas e compreendidas usando as regras matemáticas da mecânica quântica.
A matemática usada para estudar partículas subatômicas e ondas eletromagnéticas é muito complexa, pois elas agem de formas muito estranhas.
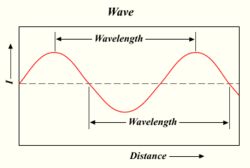
O comprimento de onda de uma onda de luz
Ondas e fótons
Os fótons são partículas muito menores do que átomos e prótons e elétrons; na verdade, eles não têm nenhuma massa. Os fótons são como "pacotes" ou pacotes de energia. Fontes de luz tais como velas ou lasers disparam (ou "emitem") luz em bits chamados fótons.
Quanto mais fótons uma lâmpada dispara, mais brilhante é a luz. A luz é uma forma de energia que se comporta como as ondas na água ou ondas de rádio. A distância entre o topo de uma onda e o topo da onda seguinte é chamada de "comprimento de onda". Cada fóton transporta uma certa quantidade, ou 'quantum', de energia, dependendo de seu comprimento de onda.
A cor de uma luz depende de seu comprimento de onda. A cor violeta (a cor inferior ou mais interna do arco-íris) tem um comprimento de onda de cerca de 400 nm ("nanômetros") que é de 0,00004 centímetros ou 0,000016 polegadas. Fótons com comprimentos de onda de 10-400 nm são chamados de luz ultravioleta (ou UV). Tal luz não pode ser vista pelo olho humano. Na outra extremidade do espectro, a luz vermelha é de cerca de 700 nm. A luz infravermelha é de cerca de 700 nm a 300.000 nm. Os olhos humanos também não são sensíveis à luz infravermelha.
Os comprimentos de onda nem sempre são tão pequenos. As ondas de rádio têm comprimentos de onda mais longos. Os comprimentos de onda para um rádio FM podem ter vários metros de comprimento (por exemplo, estações transmitindo em 99,5 FM estão emitindo energia de rádio com um comprimento de onda de cerca de 3 metros, que é de cerca de 10 pés). Cada fóton tem uma certa quantidade de energia relacionada ao seu comprimento de onda. Quanto menor o comprimento de onda de um fóton, maior será sua energia. Por exemplo, um fóton ultravioleta tem mais energia do que um fóton infravermelho.
Comprimento de onda e freqüência (o número de vezes as cristas de onda por segundo) são inversamente proporcionais, o que significa que um comprimento de onda mais longo terá uma freqüência menor, e vice-versa. Se a cor da luz for infravermelha (menor em freqüência do que a luz vermelha), cada fóton pode aquecer o que ele atinge. Assim, se uma lâmpada infravermelha forte (uma lâmpada de calor) estiver apontada para uma pessoa, ela se sentirá quente, ou mesmo quente, por causa da energia armazenada nos muitos fótons. A superfície da lâmpada infravermelha pode até ficar quente o suficiente para queimar alguém que possa tocá-la. Os humanos não podem ver a luz infravermelha, mas podemos sentir a radiação sob a forma de calor. Por exemplo, uma pessoa passando por um edifício de tijolos que foi aquecido pelo sol sentirá o calor do edifício sem ter que tocá-lo.
As formulações matemáticas da mecânica quântica são abstratas. Uma função matemática, chamada função de onda, fornece informações sobre a amplitude de probabilidade (o quadrado da amplitude de probabilidade é a probabilidade) de posição, momento e outras propriedades físicas de uma partícula. Muitos dos resultados da mecânica quântica não são facilmente visualizados em termos da mecânica clássica.
A luz ultravioleta é maior em freqüência do que a luz violeta, de tal forma que não está nem mesmo na faixa de luz visível. Cada fóton na faixa de luz ultravioleta tem muita energia, suficiente para ferir as células da pele e causar uma queimadura solar. Na verdade, a maioria das formas de queimaduras solares não são causadas pelo calor; elas são causadas pela alta energia dos raios UV do sol que danificam as células da pele. Frequências ainda mais altas de luz (ou radiação eletromagnética) podem penetrar mais profundamente no corpo e causar ainda mais danos. Os raios X têm tanta energia que podem penetrar profundamente no corpo humano e matar as células. Os seres humanos não podem ver ou sentir a luz ultravioleta ou os raios X. Eles só podem saber que estiveram sob uma luz de tão alta freqüência quando recebem uma queimadura por radiação. Áreas onde é importante matar germes muitas vezes usam lâmpadas ultravioletas para destruir bactérias, fungos, etc. Os raios X são às vezes usados para matar células cancerígenas.
A mecânica quântica começou quando foi descoberto que uma certa freqüência significa uma certa quantidade de energia. A energia é proporcional à freqüência (E ∝ f). Quanto maior a freqüência, mais energia um fóton tem, e mais danos pode causar. A mecânica quântica cresceu mais tarde para explicar a estrutura interna dos átomos. A mecânica quântica também explica a forma como um fóton pode interferir em si mesmo, e muitas outras coisas nunca imaginadas na física clássica.
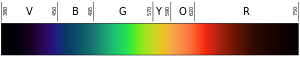
O preto à esquerda é ultravioleta (alta freqüência); o preto à direita é infravermelho (baixa freqüência).
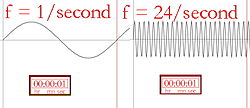
Descrição pictórica da freqüência
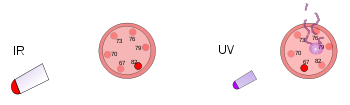
À esquerda, um termômetro de plástico está sob uma lâmpada de calor brilhante. Esta radiação infravermelha aquece, mas não danifica o termômetro. À direita, outro termômetro de plástico é atingido por uma luz ultravioleta de baixa intensidade. Esta radiação danifica, mas não aquece o termômetro.
Quantization
Max Planck descobriu a relação entre freqüência e energia. Ninguém antes havia adivinhado que a freqüência é diretamente proporcional à energia (isto significa que como um deles duplica, o outro também duplica). Sob o que são chamadas unidades naturais, então o número que representa a freqüência de um fóton também representaria sua energia. A equação seria então:
E = f
significando energia igual a freqüência.
Mas a forma como a física cresceu, não havia conexão natural entre as unidades que eram usadas para medir energia e as unidades comumente usadas para medir o tempo (e, portanto, a freqüência). Assim, a fórmula que o Planck elaborou para fazer com que todos os números saíssem corretamente foi:
E = h × f
ou, energia igual a h vezes a freqüência. Este h é um número chamado Planck's constante após seu descobridor.
A mecânica quântica se baseia no conhecimento de que um fóton de certa freqüência significa um fóton de certa quantidade de energia. Além dessa relação, um tipo específico de átomo só pode emitir certas freqüências de radiação, portanto, também só pode emitir fótons que possuem certas quantidades de energia.
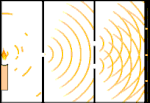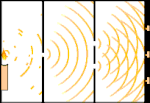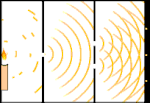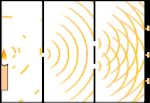
Experiência de dupla iluminação: a luz vai da fonte de luz à esquerda para as franjas (marcadas na borda preta) à direita.
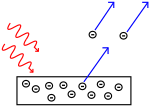
Efeito fotoelétrico: os fótons atingem o metal e os elétrons são empurrados para longe.
História
Isaac Newton pensou que a luz era feita de coisas muito pequenas que agora chamaríamos de partículas (ele se referiu a elas como "Corpuscles"). Christiaan Huygens pensava que a luz era feita de ondas. Os cientistas pensavam que uma coisa não pode ser uma partícula e uma onda ao mesmo tempo.
Os cientistas fizeram experimentos para descobrir se a luz era feita de partículas ou ondas. Eles descobriram que ambas as idéias estavam certas - a luz era de alguma forma tanto de ondas quanto de partículas. O experimento Double-slit realizado por Thomas Young mostrou que a luz deve agir como uma onda. O efeito fotoelétrico descoberto por Albert Einstein provou que a luz tinha que agir como partículas que carregavam quantidades específicas de energia, e que as energias estavam ligadas a suas freqüências. Este resultado experimental é chamado de "dualidade onda-partícula" na mecânica quântica. Mais tarde, os físicos descobriram que tudo se comporta tanto como uma onda quanto como uma partícula, não apenas como luz. Entretanto, este efeito é muito menor em objetos grandes.
Aqui estão algumas das pessoas que descobriram as partes básicas da mecânica quântica: Max Planck, Albert Einstein, Satyendra Nath Bose, Niels Bohr, Louis de Broglie, Max Born, Paul Dirac, Werner Heisenberg, Wolfgang Pauli, Erwin Schrödinger, John von Neumann, e Richard Feynman. Eles fizeram seu trabalho na primeira metade do século 20.

Da esquerda para a direita: Max Planck, Albert Einstein, Niels Bohr, Louis de Broglie, Max Born, Paul Dirac, Werner Heisenberg, Wolfgang Pauli, Erwin Schrödinger, Richard Feynman.
Além do Planck
As fórmulas e idéias da mecânica quântica foram feitas para explicar a luz que vem do hidrogênio incandescente. A teoria quântica do átomo também teve que explicar porque o elétron permanece em sua órbita, o que outras idéias não foram capazes de explicar. Seguiu-se das idéias mais antigas que o elétron teria que cair para o centro do átomo porque começa a ser mantido em órbita por sua própria energia, mas rapidamente perderia sua energia ao girar em sua órbita. (Isto porque os elétrons e outras partículas carregadas eram conhecidos por emitir luz e perder energia quando mudavam de velocidade ou giravam).
As lâmpadas de hidrogênio funcionam como luzes de néon, mas as luzes de néon têm seu próprio grupo único de cores (e freqüências) de luz. Os cientistas aprenderam que podiam identificar todos os elementos pelas cores de luz que produzem. Eles simplesmente não conseguiam descobrir como as freqüências eram determinadas.
Então, um matemático suíço chamado Johann Balmer descobriu uma equação que dizia o que seria λ (lambda, para comprimento de onda):
λ = B ( n 2 n 2 - 4 ) n = 3 , 4 , 5 , 6 {\i1}displaystyle {\i1}lambda = B esquerda(n^{\i}{n^2}{n^{\i}-4}}{n^2 n^2 - 4}qquadad n=3,4,5,6}
onde B é um número que Balmer determinou ser igual a 364,56 nm.
Esta equação só funcionava para a luz visível de uma lâmpada de hidrogênio. Mas, mais tarde, a equação se tornou mais geral:
1 λ = R ( 1 m 2 - 1 n 2 ) , estilo de jogo 1
onde R é a constante de Rydberg, igual a 0,0110 nm-1, e n deve ser maior que m.
Introduzindo números diferentes para m e n, é fácil prever freqüências para muitos tipos de luz (ultravioleta, visível e infravermelha). Para ver como isto funciona, vá para a Hiperfísica e passe pelo meio da página. (Use H = 1 para hidrogênio).
Em 1908, Walter Ritz fez o princípio de combinação Ritz que mostra como certos intervalos entre freqüências continuam se repetindo. Isto se revelou importante para Werner Heisenberg vários anos mais tarde.
Em 1905, Albert Einstein utilizou a idéia de Planck para mostrar que um feixe de luz é composto por um fluxo de partículas chamado fótons. A energia de cada fóton depende de sua freqüência. A idéia de Einstein é o início da idéia na mecânica quântica de que todas as partículas subatômicas como elétrons, prótons, nêutrons e outras são ao mesmo tempo ondas e partículas. Isto levou a uma teoria sobre partículas subatômicas e ondas eletromagnéticas chamada dualidade onda-partícula. Aqui é onde partículas e ondas não eram uma nem a outra, mas tinham certas propriedades de ambas.
Em 1913, Niels Bohr teve a idéia de que os elétrons só poderiam assumir certas órbitas ao redor do núcleo de um átomo. Sob a teoria de Bohr, os números chamados m e n na equação acima poderiam representar órbitas. A teoria de Bohr dizia que os elétrons poderiam começar em alguma órbita m e terminar em alguma órbita n, ou um elétron poderia começar em alguma órbita n e terminar em alguma órbita m, então se um fóton atingir um elétron, sua energia será absorvida, e o elétron se moverá para uma órbita mais alta por causa dessa energia extra. Sob a teoria de Bohr, se um elétron cair de uma órbita mais alta para uma órbita mais baixa, então ele terá que desistir de energia na forma de um fóton. A energia do fóton será igual à diferença de energia entre as duas órbitas, e a energia de um fóton faz com que ele tenha uma certa freqüência e cor. A teoria de Bohr forneceu uma boa explicação de muitos aspectos dos fenômenos subatômicos, mas não respondeu porque cada uma das cores da luz produzida pelo hidrogênio incandescente (e pelo néon incandescente ou qualquer outro elemento) tem um brilho próprio, e as diferenças de brilho são sempre as mesmas para cada elemento.

Na época em que Niels Bohr publicou sua teoria, a maioria das coisas sobre a luz produzida por uma lâmpada de hidrogênio eram conhecidas, mas os cientistas ainda não conseguiam explicar o brilho de cada uma das linhas produzidas pelo hidrogênio incandescente.
Werner Heisenberg assumiu a tarefa de explicar o brilho ou "intensidade" de cada linha. Ele não podia usar nenhuma regra simples como a que Balmer havia inventado. Ele teve que usar a matemática muito difícil da física clássica que calcula tudo em termos de coisas como a massa (peso) de um elétron, a carga (força elétrica estática) de um elétron, e outras pequenas quantidades. A física clássica já tinha respostas para o brilho das faixas de cor que uma lâmpada de hidrogênio produz, mas a teoria clássica dizia que deveria haver um arco-íris contínuo, e não quatro faixas de cor separadas. A explicação de Heisenberg é:
Há alguma lei que diz quais freqüências de hidrogênio incandescente produzirá. Ela tem que prever freqüências espaçadas quando os elétrons envolvidos estão se movendo entre órbitas próximas ao núcleo (centro) do átomo, mas também tem que prever que as freqüências se aproximarão cada vez mais enquanto observamos o que o elétron faz ao se mover entre órbitas cada vez mais distantes. Também terá que prever que as diferenças de intensidade entre as freqüências se aproximarão cada vez mais à medida que nos afastamos. Onde a física clássica já dá as respostas corretas por um conjunto de equações, a nova física tem que dar as mesmas respostas, mas por equações diferentes.
A física clássica usa os métodos do matemático francês Fourier para fazer uma imagem matemática do mundo físico, e usa coleções de curvas suaves que vão juntas para fazer uma curva suave que dá, neste caso, intensidades para a luz de todas as freqüências de alguma luz. Mas não é correto porque essa curva lisa só aparece em freqüências mais altas. Nas freqüências mais baixas, há sempre pontos isolados e nada liga os pontos. Assim, para fazer um mapa do mundo real, Heisenberg teve que fazer uma grande mudança. Ele teve que fazer algo para escolher apenas os números que correspondessem ao que era visto na natureza. Às vezes as pessoas dizem que ele "adivinhou" estas equações, mas ele não estava fazendo adivinhações cegas. Ele encontrou o que precisava. Os números que ele calculava colocariam pontos em um gráfico, mas não haveria nenhuma linha traçada entre os pontos. E fazer um "gráfico" apenas de pontos para cada conjunto de cálculos teria desperdiçado muito papel e não teria conseguido fazer nada. Heisenberg encontrou uma maneira de prever eficientemente as intensidades para diferentes freqüências e de organizar essas informações de uma maneira útil.
Apenas usando a regra empírica dada acima, aquela que Balmer iniciou e Rydberg melhorou, podemos ver como obter um conjunto de números que ajudaria Heisenberg a obter o tipo de imagem que ele queria:
A regra diz que quando o elétron se move de uma órbita para outra, ou ganha ou perde energia, dependendo se ele está se afastando do centro ou se está mais próximo dele. Assim, podemos colocar estas órbitas ou níveis de energia como cabeçalhos ao longo do topo e do lado de uma grade. Por razões históricas, a órbita mais baixa é chamada n, e a próxima órbita é chamada n - a, depois vem n - b, e assim por diante. É confuso que eles usaram números negativos quando os elétrons estavam realmente ganhando energia, mas é assim que as coisas são.
Como a regra de Rydberg nos dá frequências, podemos usar essa regra para colocar em números, dependendo de para onde o elétron vai. Se o elétron começa em n e termina em n, então ele não foi realmente a lugar algum, então não ganhou energia e não perdeu energia. Portanto, a freqüência é 0. Se o elétron começa em n-a e termina em n, então ele caiu de uma órbita maior para uma órbita menor. Se o fizer, perde energia, e a energia que perde aparece como um fóton. O fóton tem uma certa quantidade de energia, e, e isso está relacionado a uma certa freqüência f pela equação e = h f. Assim, sabemos que uma certa mudança de órbita vai produzir uma certa freqüência de luz, f. Se o elétron começa em n e termina em n - a, isso significa que ele passou de uma órbita mais baixa para uma órbita mais alta. Isso só acontece quando um fóton de certa freqüência e energia vem de fora, é absorvido pelo elétron e lhe dá sua energia, e é isso que faz o elétron sair para uma órbita mais alta. Assim, para manter tudo fazendo sentido, escrevemos essa freqüência como um número negativo. Havia um fóton com uma certa freqüência e agora ele foi tirado.
Assim, podemos fazer uma grade como esta, onde f(a←b) significa a freqüência envolvida quando um elétron passa do estado de energia (órbita) b para o estado de energia a (Novamente, as seqüências olham para trás, mas esta é a forma como foram escritas originalmente):
Grade de f
| Estados Elétricos | n | n-a | n-b | n-c | .... | |
| n | f(n←n) | f(n←n-a) | f(n←n-b) | f(n←n-c) | ..... | |
| n-a | f(n-a←n) | f(n-a←n-a) | f(n-a←n-b) | f(n-a←n-c) | ..... | |
| n-b | f(n-b←n) | f(n-b←n-a) | f(n-b←n-b) | f(n-b←n-c) | ..... | |
| transição .... | ..... | ..... | ..... | ..... |
Heisenberg não fez as grades desta maneira. Ele apenas fez as contas que lhe permitiriam obter as intensidades que ele procurava. Mas para fazer isso, ele teve que multiplicar duas amplitudes (quão alta uma onda mede) para trabalhar a intensidade. (Na física clássica, intensidade igual a amplitude ao quadrado.) Ele fez uma equação de aparência estranha para lidar com este problema, escreveu o resto de seu trabalho, entregou-o a seu chefe e foi de férias. O Dr. Born olhou para sua equação engraçada e parecia um pouco louco. Ele deve ter se perguntado: "Por que Heisenberg me deu esta coisa estranha? Por que ele tem que fazer desta maneira?" Então ele percebeu que estava olhando para uma planta de algo que ele já conhecia muito bem. Ele estava acostumado a chamar a grade ou a mesa que podíamos escrever fazendo, por exemplo, toda a matemática para as freqüências, uma matriz. E a estranha equação de Heisenberg era uma regra para multiplicar duas delas juntas. Max Born era um matemático muito, muito bom. Ele sabia que como as duas matrizes (grades) sendo multiplicadas representavam coisas diferentes (como posição (x,y,z) e momento (mv), por exemplo), então quando você multiplica a primeira matriz pelo segundo você obtém uma resposta e quando você multiplica a segunda matriz pela primeira matriz você obtém outra resposta. Mesmo não conhecendo a matemática matricial, Heisenberg já via este problema das "respostas diferentes" e isso o incomodara. Mas o Dr. Born era um matemático tão bom que viu que a diferença entre a primeira multiplicação de matrizes e a segunda multiplicação de matrizes sempre envolveria a constante de Planck, h, multiplicada pela raiz quadrada da negativa, i. Assim, poucos dias após a descoberta de Heisenberg eles já tinham a matemática básica para o que Heisenberg gostava de chamar de "princípio da indeterminação". Por "indeterminado" Heisenberg significava que algo como um elétron não é simplesmente fixado até que seja fixado. É um pouco como uma água-viva que está sempre se espremendo e não pode estar "em um só lugar", a menos que você a mate. Mais tarde, as pessoas adquiriram o hábito de chamá-lo de "princípio da incerteza de Heisenberg", o que fez muitas pessoas cometerem o erro de pensar que elétrons e coisas assim estão realmente "em algum lugar", mas nós temos dúvidas sobre isso em nossas próprias mentes. Essa idéia é errada. Não era sobre isso que Heisenberg estava falando. Ter problemas para medir algo é um problema, mas não é o problema do qual Heisenberg estava falando.
A idéia de Heisenberg é muito difícil de entender, mas podemos torná-la mais clara com um exemplo. Primeiro, vamos começar a chamar estas grades de "matrizes", porque em breve precisaremos falar sobre multiplicação de matrizes.
Suponha que comecemos com dois tipos de medidas, posição (q) e momento (p). Em 1925, Heisenberg escreveu uma equação como esta:
Y ( n , n - b ) = ∑ a p ( n , n - a ) q ( n - a , n - b ) {\i1}displaystyle Y(n,n-b)==sum _{a}^{},p(n,n-a)q(n-a,n-b)} 
Ele não sabia, mas esta equação dá um plano para escrever duas matrizes (grades) e para multiplicá-las. As regras para multiplicar uma matriz por outra são um pouco confusas, mas aqui estão as duas matrizes de acordo com o plano, e depois o produto delas:
Matriz de p
| Estados Elétricos | n-a | n-b | n-c | .... | |
| n | p(n←n-a) | p(n←n-b) | p(n←n-c) | ..... | |
| n-a | p(n-a←n-a) | p(n-a←n-b) | p(n-a←n-c) | ..... | |
| n-b | p(n-b←n-a) | p(n-b←n-b) | p(n-b←n-c) | ..... | |
| transição .... | ..... | ..... | ..... | ..... |
Matriz de q
| Estados Elétricos | n-b | n-c | n-d | .... | |
| n-a | q(n-a←n-b) | q(n-a←n-c) | q(n-a←n-d) | ..... | |
| n-b | q(n-b←n-b) | q(n-b←n-c) | q(n-b←n-d) | ..... | |
| n-c | q(n-c←n-b) | q(n-c←n-c) | q(n-c←n-d) | ..... | |
| transição .... | ..... | ..... | ..... | ..... |
A matriz para o produto das duas matrizes acima conforme especificado pela equação relevante no papel de Heisenberg de 1925 é:
| Estados Elétricos | n-b | n-c | n-d | ..... |
| n | A | ..... | ..... | ..... |
| n-a | ..... | B | ..... | ..... |
| n-b | ..... | ..... | C | ..... |
Onde:
A=p(n←n-a)*q(n-a←n-b)+p(n←n-b)*q(n-b←n-b)+p(n←n-c)*q(n-c←n-b)+ .....
B=p(n-a←n-a)*q(n-a←n-c)+p(n-a←n-b)*q(n-b←n-c)+p(n-a←n-c)*q(n-c←n-c)+ .....
C=p(n-b←n-a)*q(n-a←n-d)+p(n-b←n-b)*q(n-b←n-d)+p(n-b←n-c)*q(n-d←n-d)+ .....
e assim por diante.
Se as matrizes fossem invertidas, o resultado seriam os seguintes valores:
A=q(n←n-a)*p(n-a←n-b)+q(n←n-b)*p(n-b←n-b)+q(n←n-c)*p(n-c←n-b)+.....
B=q(n-a←n-a)*p(n-a←n-c)+q(n-a←n-b)*p(n-a←n-b)*p(n-b←n-c)+q(n-a←n-c)*p(n-c←n-c)+.....
C=q(n-b←n-a)*p(n-a←n-d)+q(n-b←n-b)*p(n-b←n-d)+q(n-b←n-c)*p(n-d←n-d)+ .....
e assim por diante.
Observe como a mudança da ordem de multiplicação muda os números, passo a passo, que são realmente multiplicados.

Luz visível emitida por hidrogênio incandescente. (Comprimentos de onda em nanômetros).
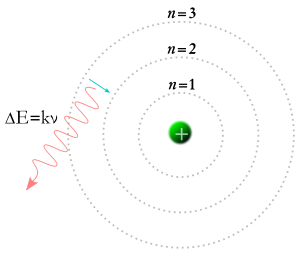
Um elétron cai em órbita inferior e um fóton é criado.
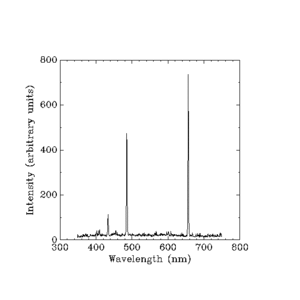
Intensidades espaçadas em unidades arbitrárias
Além de Heisenberg
O trabalho de Werner Heisenberg pareceu quebrar um engarrafamento de troncos. Muito em breve, muitas outras formas diferentes de explicar as coisas vieram de pessoas como Louis de Broglie, Max Born, Paul Dirac, Wolfgang Pauli, e Erwin Schrödinger. O trabalho de cada um destes físicos é a sua própria história. A matemática usada por Heisenberg e pessoas anteriores não é muito difícil de entender, mas as equações rapidamente se tornaram muito complicadas à medida que os físicos olhavam mais profundamente para o mundo atômico.
Outros mistérios
Nos primeiros tempos da mecânica quântica, Albert Einstein sugeriu que, se estivesse certo, a mecânica quântica significaria que haveria "uma ação assustadora à distância". Descobriu-se que a mecânica quântica estava certa, e que o que Einstein havia usado como motivo para rejeitar a mecânica quântica realmente aconteceu. Este tipo de "conexão fantasmagórica" entre certos eventos quânticos é agora chamado de "enredamento quântico".
Quando uma experiência reúne duas coisas (fótons, elétrons, etc.), elas devem então compartilhar uma descrição comum em mecânica quântica. Quando mais tarde são separados, eles mantêm a mesma descrição mecânica quântica ou "estado". No diagrama, uma característica (por exemplo, giro "para cima") é desenhada em vermelho, e sua companheira (por exemplo, giro "para baixo") é desenhada em azul. A faixa roxa significa que quando, por exemplo, dois elétrons são colocados juntos, o par compartilha ambas as características. Assim, ambos os elétrons podem aparecer tanto no giro para cima quanto no giro para baixo. Quando mais tarde são separados, um permanece na Terra e outro vai para algum planeta da estrela Alfa Centauri, cada um deles ainda tem os dois giros. Em outras palavras, cada um deles pode "decidir" mostrar-se como um elétron spin-up ou spin-down. Mas se mais tarde alguém mede o outro, deve "decidir" mostrar-se como tendo o giro oposto.
Einstein argumentou que a uma distância tão grande era uma loucura pensar que forçar um elétron a mostrar seu giro faria de alguma forma com que o outro elétron mostrasse uma característica oposta. Ele disse que os dois elétrons devem ter sido girados para cima ou para baixo o tempo todo, mas que a mecânica quântica não podia prever qual característica cada elétron tinha. Não sendo capaz de prever, apenas ser capaz de olhar para um deles com a experiência correta, significava que a mecânica quântica não poderia ser responsável por algo importante. Portanto, disse Einstein, a mecânica quântica tinha um grande buraco. A mecânica quântica estava incompleta.
Mais tarde, verificou-se que os experimentos mostraram que era Einstein quem estava errado.
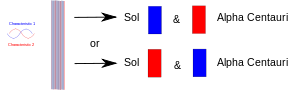
Duas partículas enredadas são separadas: uma na Terra e outra levada para algum planeta distante. Medir uma delas força-a a "decidir" qual papel tomar, e a outra deve então tomar o outro sempre que (depois disso) for medida.
Princípio da incerteza de Heisenberg
Em 1925, Werner Heisenberg descreveu o princípio da Incerteza, que diz que quanto mais sabemos sobre onde uma partícula está, menos podemos saber sobre a velocidade e em que direção ela está indo. Em outras palavras, quanto mais sabemos sobre a velocidade e a direção de algo pequeno, menos podemos saber sobre sua posição. Os físicos geralmente falam sobre o impulso em tais discussões ao invés de falar sobre velocidade. O momento é apenas a velocidade de algo em uma determinada direção vezes sua massa.
A razão por trás do princípio de incerteza de Heisenberg diz que nunca podemos saber tanto a localização quanto o impulso de uma partícula. Como a luz é uma partícula abundante, ela é usada para medir outras partículas. A única maneira de medi-la é fazer ricochetear a onda de luz da partícula e registrar os resultados. Se um feixe de luz de alta energia, ou alta freqüência, for utilizado, podemos dizer exatamente onde ele está, mas não podemos dizer a que velocidade ele estava indo. Isto porque o fóton de alta energia transfere energia para a partícula e muda a velocidade da partícula. Se utilizarmos um fóton de baixa energia, podemos dizer a que velocidade ele está indo, mas não onde ele está. Isto é porque estamos usando luz com um comprimento de onda maior. O comprimento de onda mais longo significa que a partícula pode estar em qualquer lugar ao longo do trecho da onda.
O princípio também diz que existem muitos pares de medidas para as quais não podemos conhecer ambos sobre qualquer partícula (uma coisa muito pequena), não importa o quanto tentemos. Quanto mais aprendemos sobre um desses pares, menos podemos saber sobre o outro.
Até mesmo Albert Einstein teve dificuldade em aceitar um conceito tão bizarro, e em um debate bem conhecido disse: "Deus não joga dados". A isto, o famoso físico dinamarquês Niels Bohr respondeu: "Einstein, não diga a Deus o que fazer".
Usos da QM
Os elétrons circundam cada núcleo do átomo. Ligações químicas ligam átomos para formar moléculas. Uma ligação química liga dois átomos quando os elétrons são compartilhados entre esses átomos. Assim, QM é a física da ligação química e da química. O QM nos ajuda a entender como as moléculas são feitas, e quais são suas propriedades.
A QM também pode nos ajudar a entender coisas grandes, como estrelas e até mesmo todo o universo. A QM é uma parte muito importante da teoria de como o universo começou, chamada de Big Bang.
Tudo o que é feito de matéria é atraído por outra matéria por causa de uma força fundamental chamada gravidade. A teoria de Einstein que explica a gravidade é chamada de teoria da relatividade geral. Um problema na física moderna é que algumas conclusões da QM parecem não estar de acordo com a teoria da relatividade geral.
QM é a parte da física que pode explicar porque toda a tecnologia eletrônica funciona como funciona. Assim, a QM explica como os computadores funcionam, porque os computadores são máquinas eletrônicas. Mas os projetistas do hardware dos primeiros computadores, por volta de 1950 ou 1960, não precisavam pensar em QM. Os projetistas de rádios e televisores daquela época também não pensavam em QM. No entanto, o projeto dos circuitos integrados mais poderosos e tecnologias de memória de computador dos últimos anos exige QM.
A QM também tornou possíveis tecnologias tais como:
Por que a QM é difícil de aprender
A QM é um assunto desafiador por várias razões:
- A QM explica as coisas de maneiras muito diferentes do que aprendemos sobre o mundo quando somos crianças.
- A compreensão da QM requer mais matemática do que álgebra e cálculo simples. Também requer álgebra matricial, números complexos, teoria da probabilidade e equações diferenciais parciais.
- Os físicos não estão certos do que algumas das equações da QM nos dizem sobre o mundo real.
- A QM sugere que os átomos e as partículas subatômicas se comportam de maneira estranha, completamente diferente de tudo que vemos em nossa vida cotidiana.
- A QM descreve coisas que são extremamente pequenas, portanto não podemos ver algumas delas sem equipamento especial, e não podemos ver muitas delas de maneira alguma.
A QM descreve a natureza de uma forma diferente de como geralmente pensamos sobre a ciência. Ela nos diz como é provável que algumas coisas aconteçam, em vez de nos dizer que elas certamente acontecerão.
Um exemplo é o experimento de dupla fenda de Young. Se fotografarmos fótons simples (unidades simples de luz) a partir de um laser em uma folha de filme fotográfico, veremos um único ponto de luz no filme revelado. Se colocarmos uma folha de metal no meio, e fizermos duas fendas muito estreitas na folha, quando disparamos muitos fótons na folha de metal, e eles têm que passar através das fendas, então veremos algo notável. Em toda a folha de filme desenvolvido, veremos uma série de faixas brilhantes e escuras. Podemos usar a matemática para dizer exatamente onde as bandas brilhantes estarão e quão brilhante foi a luz que as fez, ou seja, podemos dizer antecipadamente quantos fótons cairão em cada banda. Mas se desacelerarmos o processo e virmos onde cada fóton cairá na tela, nunca poderemos dizer com antecedência onde o próximo aparecerá. Podemos saber com certeza que é muito provável que um fóton atinja a banda brilhante central, e que é cada vez menos provável que um fóton apareça em bandas cada vez mais distantes do centro. Portanto, sabemos com certeza que as bandas serão mais brilhantes no centro e ficarão cada vez mais escuras e mais distantes do centro. Mas nunca sabemos ao certo qual fóton irá em qual banda.
Uma das estranhas conclusões da teoria QM é o efeito "gato de Schrödinger". Certas propriedades de uma partícula, tais como sua posição, velocidade de movimento, direção de movimento e "giro", não podem ser faladas até que algo as meça (um fóton saltando de um elétron contaria como uma medida de sua posição, por exemplo). Antes da medição, a partícula está em uma "superposição de estados", nos quais suas propriedades têm muitos valores ao mesmo tempo. Schrödinger disse que a mecânica quântica parecia dizer que se algo (como a vida ou morte de um gato) fosse determinado por um evento quântico, então seu estado seria determinado pelo estado resultante do evento quântico, mas somente no momento em que alguém olhasse para o estado do evento quântico. No tempo antes do estado do evento quântico ser analisado, talvez "o gato vivo e morto (perdoe a expressão) [estejam] misturados ou manchados em partes iguais".
A constante do Planck Reduzido
As pessoas usam frequentemente o símbolo ℏ 

Exemplo
A partícula em um poço unidimensional é o exemplo mais simples mostrando que a energia de uma partícula só pode ter valores específicos. Diz-se que a energia é "quantizada". O poço tem energia potencial zero dentro de uma faixa e tem energia potencial infinita em todos os lugares fora dessa faixa. Para o caso unidimensional na 
- ℏ 2 2 m d 2 ψ d x 2 = E ψ . estilo de jogo -frac {\i1}{2m}{2m}}{drac {d^{2}psi {dx^{2}}=Ex^2}psi . }
Usando equações diferenciais, podemos ver que ψ 
ψ = A e i k x + B e - i k x E = ℏ 2 k 2 m {\i1}displaystyle {\i} = Ae^{\i^x}+Be^{\i^^^;;;;;{\i^2m}}
ou
ψ = C sin k x + D cos k x {\i1}displaystyle {\i1}psi =Csin kx+D\i}cos kx; } 
As paredes da caixa significam que a função de onda deve ter uma forma especial. A função de onda da partícula deve ser zero sempre que as paredes forem infinitamente altas. Em cada parede:
ψ = 0 a t x = 0 , x = L {\psi =0;mathrm {\psi =0,x=0,x=L}
Considere x = 0
- pecado 0 = 0, porque 0 = 1. Para satisfazer ψ = 0 {\\i1}estilo de escrita {\i0}; {\i1}
o termo cos tem que ser removido. Daí D = 0
Agora considere: ψ = C sin k x {\i1}displaystyle {\i}scriptstyle {\i}psi =Csin kx; {\i}
- em x = L, ψ = C sin k L = 0 {\\i1}sin kL=0; {\i1}
- Se C = 0, então ψ = 0 {\i1}estilo de escrita {\i1}psi = 0; }
para todos os x. Esta solução não é útil.
- portanto, o pecado kL = 0 deve ser verdadeiro, dando-nos
k L = n π n = 1 , 2 , 3 , 4 , 5 , . . kL=npi;;;n=1,2,3,4,5,...;
Podemos ver que n {\i1}o estilo de jogo n {\i} 
Páginas relacionadas
- Onda eletromagnética
- Elétron
- Fóton
- Emaranhamento quântico
- equação de Schrödinger
Perguntas e Respostas
P: O que é a mecânica quântica?
R: A mecânica quântica é um ramo da física que explica como o universo funciona a uma escala menor do que os átomos. É também conhecida como física quântica ou teoria quântica.
P: O que significa o termo "quântica"?
R: O termo "quantum" vem do latim e significa "quanto". Um quantum de energia é a menor quantidade possível (ou a menor quantidade extra), e a mecânica quântica descreve como essa energia se move ou interage.
P: O que são partículas subatómicas?
R: Partículas subatómicas são partículas que compõem átomos, tais como prótons, neutrões, e electrões. Elas são ainda mais pequenas que os átomos.
P: Como é que a mecânica quântica descreve como estas partículas funcionam?
R: A mecânica quântica fornece regras matemáticas para estudar partículas subatómicas e ondas electromagnéticas a fim de compreender o seu comportamento e interacções entre elas.
P: O que é a dualidade onda-partícula?
R: A dualidade onda-partícula refere-se ao facto de ambas as partículas e ondas se poderem comportar uma como a outra - não são duas entidades distintas, mas sim algo como ambas combinadas num único fenómeno.
P: Como pode a física moderna ser descrita usando a mecânica quântica?
R: A física e a química modernas podem ser explicadas através da aplicação das regras matemáticas da mecânica quântica a elas.
Pesquise na enciclopédia







