Carbonização
Uma carbonização é um íon com um átomo de carbono carregado de forma positiva. O átomo de carbono carregado em um carbocado é um "sexteto" (ou seja, ele tem apenas seis elétrons em sua casca de valência externa ao invés de oito elétrons de valência). Os átomos de carbono com oito valências eleitorais têm a máxima estabilidade (regra do octeto). Portanto, as carbonações são freqüentemente reativas, procurando preencher o octeto de elétrons de valência, bem como recuperar uma carga neutra. A lógica diria que a carbonização tem hibridização sp3 com um orbital sp3 vazio dando carga positiva. Entretanto, a reatividade de uma carbonização assemelha-se mais à hibridação sp2 com uma geometria molecular planar trigonal.
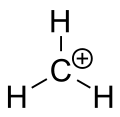
íon de carbênio de metano

catião terc-butílico, demonstrando a geometria planar
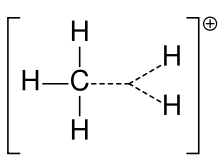
íon de carbono de metano
Definições
Um carbonato de carbono era anteriormente chamado freqüentemente de íon de carbono, mas os químicos questionam o significado exato. Na química atual, uma carbonocação é qualquer átomo de carbono com carga positiva. Dois tipos especiais foram sugeridos: os íons de carbônio são trivalentes e os íons de carbônio são pentavalentes ou hexavalentes. Os livros didáticos de nível universitário só discutem as carbonocações como se fossem íons de carbônio, ou discutem as carbonocações com uma referência fugaz à frase antiga de íons de carbônio ou íons de carbônio e íons de carbônio. Um livro didático até hoje permanece com o nome mais antigo de íon de carbonio para íon de carbenio e reserva a frase íon de carbenio hipervalente para CH5+.
História
Em 1891, G. Merling informou que adicionou bromo ao tropilideno (cicloheptatrieno) e depois aqueceu o produto para obter um material cristalino e solúvel em água, C
7H
7Br. Ele não sugeriu uma estrutura para ele; porém Doering e Knox mostraram convincentemente que era brometo de tropylium (cicloheptatrienylium). Este íon é previsto como aromático pela Regra de Hückel.
Em 1902, Norris e Kehrman descobriram independentemente que o trifenilmetanol incolor dava soluções amarelas profundas em ácido sulfúrico concentrado. Os complexos de trifenilmetilcloreto de laranja formados de forma semelhante com alumínio e cloretos de estanho. Em 1902, Adolf von Baeyer reconheceu o caráter semelhante ao sal dos compostos formados.

Ele chamou a relação entre a cor e a formação de sal de halocromia, da qual o verde malaquita é um excelente exemplo.
Os carboidratos são intermediários reativos em muitas reações orgânicas. Esta idéia, proposta pela primeira vez por Julius Stieglitz em 1899, foi mais desenvolvida por Hans Meerwein em seu estudo de 1922 sobre o rearranjo de Wagner-Meerwein. Descobriu-se que os carboidratos também estavam envolvidos na reaçãoSN1, na reação E1 e em reações de rearranjo como o turno Whitmore 1,2. O estabelecimento químico estava relutante em aceitar a noção de carbonização e durante muito tempo o Journal of the American Chemical Society recusou artigos que os mencionassem.
O primeiro espectro NMR de uma carbonização estável em solução foi publicado por Doering et al. em 1958. Foi o íon heptametilbenzenônio, feito pelo tratamento do hexametilbenzeno com cloreto de metila e cloreto de alumínio. O catião 7-norbornadienil estável foi preparado por Story et al. em 1960 por reação do cloreto de norbornadienil com tetrafluoroborato de prata em dióxido de enxofre a -80 °C. O espectro NMR estabeleceu que ele era não-clássico (o primeiro íon estável não-clássico observado).
Em 1962, Olah observou diretamente a carbonização terc-butil por ressonância magnética nuclear como uma espécie estável na dissolução do fluoreto de terc-butil em ácido mágico. O NMR do catião norbornyl foi relatado pela primeira vez por Schleyer et al. e foi mostrado por Saunders et al.
Imóveis
Na química orgânica, uma carbonização é freqüentemente o alvo do ataque nucleófilo de nucleófilos como íons hidroxila (OH-) ou íons halógenos.
Os carboidratos são classificados como primários, secundários ou terciários, dependendo do número de átomos de carbono ligados ao carbono ionizado. Os carbonos primários têm um ou zero carbonos ligados ao carbono ionizado, os secundários têm dois carbonos ligados ao carbono ionizado, e os terciários têm três carbonos ligados ao carbono ionizado.
A estabilidade da carbonização aumenta com o número de grupos alquílicos ligados ao carbono portador da carga. As carbonocações terciárias são mais estáveis (e formam mais facilmente) do que as carbonocações secundárias; as carbonocações primárias são altamente instáveis porque, enquanto os carbonos ionizados de ordem superior são estabilizados por hiperconjugação, os carbonos não-substituídos (primários) não são. Portanto, reações tais como a reaçãoSN1 e a reação de eliminação E1 normalmente não ocorrem se uma carbonização primária fosse formada. Uma exceção a isto ocorre quando há uma dupla ligação carbono-carbono junto ao carbono ionizado. Tais cátions como cátion alélico CH2=CH-CH2+ e cátion benzílico C6H5-CH2+ são mais estáveis do que a maioria dos outros carbonos. As moléculas que podem formar carbonatos de alilo ou benzilo são especialmente reativas.
Os carboidratos sofrem reações de rearranjo de estruturas menos estáveis para estruturas igualmente estáveis ou mais estáveis com taxas constantes superiores a 109/seg. Este fato complica os caminhos sintéticos para muitos compostos. Por exemplo, quando o 3-pentanol é aquecido com HCl aquoso, os rearranjos de 3-pentílicos de carbocaína inicialmente formados para uma mistura estatística de 3-pentílicos e 2-pentílicos. Estes cátions reagem com o íon cloreto para produzir cerca de 1/3 de 3-cloropentano e 2/3 de 2-cloropentano.
Algumas carbonizações como o catião norbornyl exibem uma ligação mais ou menos simétrica de três centros. Os cátions deste tipo têm sido referidos como íons não clássicos. A diferença de energia entre os isômeros "clássicos" e "não-clássicos" é freqüentemente muito pequena, e geralmente há pouca ou nenhuma energia de ativação envolvida na transição entre estruturas "clássicas" e "não-clássicas". A forma "não-clássica" da carbonização de 2 butil é essencialmente 2-buteno com um próton diretamente acima do centro do que seria a dupla ligação carbono-carbono. As carbonocações "não-clássicas" já foram objeto de grande controvérsia. Uma das maiores contribuições de George Olah para a química foi a resolução desta controvérsia.
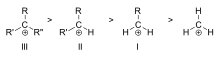
Ordem de estabilidade de exemplos de carbonato de alquilo terciário (III), secundário (II), e primário (I)
Carbocações específicas
Os cátions de ciclopropilcarbinil podem ser estudados pela NMR:

No espectro NMR de uma derivada dimetil, são encontrados dois sinais não equivalentes para os dois grupos metílicos indicando que a conformação molecular deste cátion não é perpendicular (como em A), mas é bissetada (como em B) com o p-orbital vazio e o sistema de anel ciclopropílico no mesmo plano:

Em termos da teoria dos títulos dobrados, esta preferência é explicada pela suposição de sobreposição orbital favorável entre os títulos ciclopropano dobrados cheios e os p-orbitais vazios.
Perguntas e Respostas
P: O que é um carbocátion?
R: Um carbocátion é um íon com um átomo de carbono carregado positivamente.
P: Qual é a camada de valência externa de um carbocátion?
R: A camada de valência externa de um carbocátion tem apenas seis elétrons em vez dos oito elétrons de valência estáveis.
P: Por que os carbocátions são geralmente reativos?
R: Os carbocátions são geralmente reativos porque procuram preencher o octeto de elétrons de valência e recuperar uma carga neutra.
P: Qual é a estabilidade máxima dos átomos de carbono?
R: A estabilidade máxima dos átomos de carbono é alcançada quando eles têm oito elétrons de valência.
P: O que é um sexteto em química?
R: Sexteto é um termo usado para descrever um átomo de carbono em um carbocátion que tem apenas seis elétrons em sua camada externa de valência em vez dos oito elétrons de valência estáveis.
P: Qual é a hibridização e a geometria molecular de um carbocátion?
R: Embora a lógica sugira que os carbocátions tenham hibridização sp3 com um orbital sp3 vazio que dá uma carga positiva, sua reatividade se assemelha mais à hibridização sp2 com uma geometria molecular trigonal plana.
P: O que é a regra do octeto?
R: A regra do octeto é um princípio da química que afirma que os átomos tendem a formar ligações químicas com outros átomos que permitem que ambos os átomos tenham um conjunto estável de oito elétrons de valência.
Pesquise na enciclopédia