Reações queltropicais
Reações queltropicais são um tipo de reação pericíclica onde um átomo em um dos reagentes obtém dois novos laços. Uma reação pericíclica é aquela que envolve um estado de transição com uma matriz cíclica de átomos e uma matriz cíclica associada de orbitais em interação. Uma reorganização das ligações σ e π ocorre nesta matriz cíclica.
As reações queltropicais são uma subclasse de condições cíclicas. O que diferencia as reações queltropicais é que em um dos reagentes, ambos novos laços estão sendo feitos com o mesmo átomo. Alguns exemplos são mostrados à direita na Figura 1. No primeiro caso, o átomo único é o átomo de carbono do grupo carbonilo. Esse átomo de carbono acaba em monóxido de carbono. O resultado final é fazer duas novas ligações com um átomo. Os dois primeiros exemplos são conhecidos como "extrusões queltropicais" porque uma pequena molécula estável é liberada na reação. A força motriz para estas reações é freqüentemente o benefício entropico de liberar um gás (por exemplo, CO ou N2).

Figura 1. Reações pericíclicas
Análise teórica
Devido à geometria das moléculas envolvidas nas reações queltropicais, elas confirmam uma série de previsões feitas por químicos teóricos. As reações queltropicais confirmam a conservação da simetria orbital molecular.
No estado de transição pericíclica, uma pequena molécula doa dois elétrons para o anel. Duas geometrias possíveis podem explicar a reação. A pequena molécula pode se aproximar tanto de forma linear quanto não linear. Na abordagem linear, os elétrons na órbita da pequena molécula são apontados diretamente para o sistema π da molécula grande. Na abordagem não linear, o orbital se aproxima em um ângulo ligeiramente afastado. A capacidade do sistema π de girar à medida que a pequena molécula se aproxima é crucial para formar novas ligações. A direção da rotação será diferente dependendo de quantos π-eletrões estão no sistema. Um diagrama de um fragmento de dois elétrons aproximando-se de um sistema de quatro elétrons π usando orbitais moleculares de fronteira é mostrado abaixo. A rotação será disrotatória se a pequena molécula se aproximar linearmente e conrotatória se a molécula se aproximar não linearmente. Os sistemas disrotatório e conrotatório informam como as ligações no sistema π estão girando. Disrotatório significa direções opostas enquanto conrotatório significa a mesma direção. Isto também é mostrado no diagrama abaixo.
Usando a Regra de Huckel, pode-se dizer se o sistema π é aromático ou anti-aromático. Se as abordagens aromáticas, lineares utilizam o movimento desrotatório enquanto as abordagens não lineares utilizam o movimento conrotatório. O oposto vai com um sistema anti-aromático. As abordagens lineares terão movimento conrotatório enquanto que as abordagens não lineares terão movimento disrotatório.
Reações queltropicais envolvendo SO2
Termodinâmica
Quando o dióxido de enxofre reage com butadieno e isopreno, resultam dois produtos diferentes. O mecanismo de reação controlará o que for feito. Um produto cinético e um produto termodinâmico são ambos possíveis. Mais do produto termodinâmico é feito do que o produto cinético. O produto cinético vem de uma reação Diels-Alder, enquanto que uma reação queltropica faz um produto mais estável termodinamicamente. A via queltropica é mais utilizada porque torna mais estável o adutor de anéis com cinco membros. O esquema abaixo mostra a diferença entre os dois produtos. O caminho para a esquerda mostra o produto termodinâmico, enquanto o caminho para a direita mostra o produto cinético. Suarez e Sordo mostraram isto em 1995. Eles mostraram isto ambos com experimentos e utilizando cálculos gaussianos.
Cinética
Um exemplo disso são as reações queltropicais de 1,3 dienos com dióxido de enxofre. Os químicos analisaram cuidadosamente a cinética desta reação. Em 1976, Isaacs e Laila mediram os fatores quenéticos para a adição de dióxido de enxofre aos derivados de butadieno. As taxas de adição foram monitoradas em benzeno a 30 °C com um excesso inicial de vinte vezes mais dieno. Eles usaram um espectrofotômetro para estudar a luz a 320 nm para medir o desaparecimento de SO2. A reação mostrou uma "pseudo cinética de primeira ordem". Os químicos descobriram que os grupos de retirada de elétrons sobre o dieno diminuíram a taxa de reação. Além disso, a taxa de reação foi afetada consideravelmente pelos efeitos estéreis de 2-substituintes, com grupos mais volumosos aumentando a taxa de reação. (Em outras palavras, quanto maior o grupo de átomos pendurados no segundo átomo de carbono, mais rapidamente a reação funcionava). Os autores atribuem isto à tendência dos grupos volumosos de favorecer a conformação cisoide do dieno, essencial para a reação (ver tabela abaixo). Além disso, as taxas a quatro temperaturas foram medidas para sete dos dienos. A partir destas medidas, os químicos utilizaram a equação de Arrhenius para calcular a entalpia de ativação (ΔH‡) e entropia de ativação (ΔS‡) para cada reação. Este foi um dos primeiros esforços importantes para estudar a cinética de uma reação queltropical.
| -Butadieno | 104 k /min-1 (30 °C) (± 1-2%) absoluto | 104 k /min-1 (30 °C) (± 1-2%) relativo | ΔH‡ /kcal mol-1 | ΔS‡ /cal mol-1 K-1 |
| 2-metil | 1.83 | 1.00 | 14.9 | -15 |
| 2-etil | 4.76 | 2.60 | 10.6 | -20 |
| 2-isopropil | 13.0 | 7.38 | 12.5 | -17 |
| 2-tert-butílico | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentyl | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | N/A | N/A |
| 2-bromoethyl | 0.72 | 0.39 | N/A | N/A |
| 2-p-tolyl | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenil | 17.3 | 9.45 | N/A | N/A |
| 2-(p-bromofenil) | 9.07 | 4.96 | N/A | N/A |
| 2,3-dimetil | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-metilo | 0.18 | 0.10 | N/A | N/A |
| trans-1-metilo | 0.69 | 0.38 | N/A | N/A |
| 1,2-dimetileno-ciclo-hexano | 24.7 | 13.5 | 11.4 | -16 |
| 2-metil-1,1,4,4-d4 | 1.96 | N/A | N/A | N/A |
Monnat, Vogel e Sordo, em 2002, mediram a cinética da adição de dióxido de enxofre a 1,2-dimetilidenecicloalcanos. Eles escreveram que a reação do 1,2-dimetilideneciclohexano com dióxido de enxofre pode dar dois produtos diferentes, dependendo das condições de reação. A reação faz a sultina correspondente através de uma reação hetero-Diels-Alder sob controle cinético (≤ -60 °C), mas, sob controle termodinâmico (≥ -40 °C), a reação faz o sulfoleno correspondente através de uma reação queltropical. A entalpia de ativação para a reação hetero-Diels-Alder é cerca de 2 kcal/mol menor que a correspondente reação queltropica. O sulfoleno é cerca de 10 kcal/mol mais estável do que a sultina isométrica na solução CH2Cl2/SO2.
Os autores conseguiram elaborar experimentalmente uma lei de 261,2 K para a reação de 1,2-dimetilidenociclohexano com dióxido de enxofre para dar o sulfoleno correspondente. A reação foi de primeira ordem em 1,2-dimetilideneciclohexano, mas de segunda ordem em dióxido de enxofre (ver abaixo). Isto confirmou uma previsão de químicos teóricos baseada em cálculos ab initio quantum de alto nível. Usando métodos computacionais, os autores propuseram uma estrutura de transição para a reação queltropical do 1,2-dimetilideneciclohexano com dióxido de enxofre (ver figura à direita). A reação é de segunda ordem em dióxido de enxofre porque outra molécula de dióxido de enxofre provavelmente se liga ao estado de transição para ajudar a estabilizá-lo. Resultados semelhantes foram encontrados em um estudo de Suarez, Sordo e Sordo de 1995 que utilizou cálculos ab initio para estudar o controle cinético e termodinâmico da reação de dióxido de enxofre com 1,3-dieno.
d [ 3 ] d t = k 2 [ 1 ] [ S O 2 ] 2 {\frac {dt}}=k_{2}[1][SO_{2}]^{2}} 2 {\frac {dt}}=k_{2}[SO_{2}}
Efeitos do solvente
O efeito do solvente da reação queltropical de 3,4-dimetil-2,5-dihidrotiofen-1,1-dióxido (mostrado à direita) foi investigado cinicamente em 14 solventes. As constantes de taxa de reação da reação direta e reversa, além das constantes de equilíbrio, foram encontradas linearmente correlacionadas com a escala de polaridade do solvente ET(30).
As reações foram feitas a 120 °C e foram estudadas por espectroscopia de 1H-NMR da mistura de reação. Constatou-se que a taxa de avanço k1 diminuiu por um fator de 4,5, passando do ciclohexano para o metanol. Verificou-se que a taxa inversa k-1 aumentou por um fator de 53 passando do ciclohexano para o metanol, enquanto a constante de equilíbrio Keq diminuiu por um fator de 140. Sugere-se que há uma mudança da polaridade durante o processo de ativação como evidenciado pelas relações entre os dados de equilíbrio e cinéticos. Os autores dizem que a reação parece ser influenciada pela polaridade do solvente, e isto pode ser demonstrado pela mudança nos momentos dipolares quando se passa do estado reativo para o estado de transição para o produto. Os autores também afirmam que a reação queltropica não parece ser influenciada nem pela acidez do solvente nem pela basicidade.
Os resultados deste estudo levam os autores a esperar os seguintes comportamentos:
1. A mudança na polaridade do solvente influenciará a taxa menos do que o equilíbrio.
2. As constantes de taxa serão caracterizadas pelo efeito oposto na polaridade: k1 diminuirá ligeiramente com o aumento de ET(30), e k-1 aumentará sob as mesmas condições.
3. O efeito sobre o k-1 será maior que sobre o k1.

Reação de 1,2-Dimetilidenociclohexano com SO2 Dá uma Sultina Através de uma Reação Hetero-Diels-Alder Sob Controle Cinético ou um Sulfoleno Através de uma Reação Queltropical Sob Controle Termodinâmico

Estado de transição proposto para a reação de 1,2-dimetilidenociclohexano com SO2 para dar um Sulfoleno através de uma reação queltropical
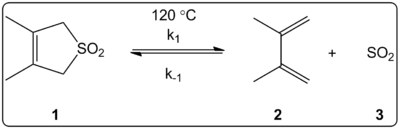
Reação Queltropica Estudada em Vários Solventes
Adições de Carbene à Alkenes
Uma das reações queltropicais mais importantes do ponto de vista sintético é a adição de um único carbene a um alkene para fazer um ciclopropano (ver figura à esquerda). Um carbeno é uma molécula neutra contendo um carbono divalente com seis elétrons em sua casca de valência. Por causa disso, os carbenes são eletrofiltros altamente reativos e gerados como intermediários de reação. Um único carbeno contém um orbital p vazio e um orbital híbrido aproximadamente sp2 que tem dois elétrons. Os carbenes singlet adicionam estereos especificamente aos alcenos, e a estereoquímica do alceno é retida no produto ciclopropano. O mecanismo para adição de um carbeno a um alqueno é uma ciclopropneumática concertada [2+1] (ver figura). Carbenes derivados de clorofórmio ou bromoforma podem ser usados para adicionar CX2 a um alceno para dar um dihalociclopropano, enquanto o reagente Simmons-Smith adiciona CH2.
A interação do orbital de carbeno cheio com o sistema alkene π cria um sistema de quatro elétrons e favorece uma abordagem não linear. Também é favorável a mistura do orbital de carbetileno vazio com o orbital de π preenchidos. A mistura favorável ocorre através de uma abordagem não-linear (ver figura 2 à direita). Entretanto, embora a teoria favoreça claramente uma abordagem não linear, não há implicações experimentais óbvias para uma abordagem linear vs. não-linear.

Adição de um Carbene a um Alkene para formar um Ciclopropano

Figura 2. A) Os Orbitais para Singlet Carbenes B) Abordagem não linear de a) Carbene sp2 Orbital e b) Carbene p Orbital
Perguntas e Respostas
P: O que é uma reação queltropical?
R: Uma reação queltropica é um tipo de reação pericíclica em que um átomo de um dos reagentes recebe dois novos títulos.
P: O que é uma reação pericíclica?
R: Uma reação pericíclica é aquela que envolve um estado de transição com uma matriz cíclica de átomos e uma matriz cíclica associada de orbitais em interação, na qual há uma reorganização dos títulos َ e ً.
P: Como isso se diferencia de outros tipos de reações?
R: Reações queltropicais são uma subclasse de condições cíclicas, e o que as diferencia de outros tipos de reações é que em um dos reagentes, ambos os novos títulos estão sendo feitos para o mesmo átomo.
P: Quais são alguns exemplos?
R: Exemplos incluem "extrusões queltropicais", como quando o único átomo do grupo carbonilo acaba em monóxido de carbono.
P: O que impulsiona essas reações?
R: A força propulsora dessas reações é freqüentemente o benefício entropico de liberar um gás (por exemplo, CO ou N2).
P: A figura 1 está relacionada a reações queltropicais? R: Sim, a figura 1 mostra exemplos de reações queltropicais.
Pesquise na enciclopédia
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)