Reação SN2
A reação SN2 (também conhecida como substituição nucleófila bimolecular) é uma reação de substituição na química orgânica. É um tipo de substituição nucleofílica, onde um par solitário de um nucleófilo ataca um centro eletrofílico deficiente em elétrons e se liga a ele. Isto expulsa um outro grupo chamado "grupo de saída". Portanto, o grupo que entra substitui o grupo que sai em uma única etapa. Como duas espécies reagentes estão envolvidas na etapa lenta e determinante da reação, isto leva ao nome de substituição nucleofílica bimolecular, ou SN2. Entre os químicos inorgânicos, a reação SN2 é freqüentemente conhecida como o mecanismo de intercâmbio.
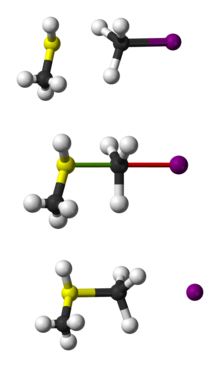
Representação esférica da reação SN2 do CH3SH com CH3I
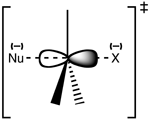
Estrutura do estado de transição SN2
Mecanismo de reação
A reação mais freqüentemente ocorre em um centro de carbono alifático sp3 com um grupo de saída estável e eletronegativo ligado a ele - 'X' - freqüentemente um átomo de haleto. A quebra da ligação C-X e a formação da nova ligação C-Nu ocorrem simultaneamente para formar um estado de transição no qual o carbono sob ataque nucleófilo é pentacoordenado, e aproximadamente sp2 hibridizado. O nucleófilo ataca o carbono a 180° para o grupo de saída, já que isto proporciona a melhor sobreposição entre o par isolado do nucleófilo e o o orbital anti-ligação C-X σ*. O grupo de saída é então empurrado para fora do lado oposto e o produto é formado.
Se o substrato sob ataque nucleófilo for quiral, isto pode levar, embora não necessariamente, a uma inversão da estereoquímica, chamada inversão de Walden.
Em um exemplo da reação SN2, o ataque de OH- (o nucleófilo) sobre um bromoetano (o eletrofilo) resulta em etanol, com brometo ejetado como o grupo de saída:
Uma reação SN2 ocorre se a rota traseira de ataque não for bloqueada por outros átomos da molécula (estericamente impedida por substitutos no substrato). Portanto, este mecanismo geralmente ocorre em um centro de carbono primário sem impedimentos. Se houver um apinhamento estéreo no substrato perto do grupo de saída, como em um centro de carbono terciário, a substituição utilizará um mecanismo SN1 em vez de um SN2 (um SN1 também seria mais provável com moléculas bloqueadas porque um intermediário de carbonização suficientemente estável poderia ser formado).
Na química de coordenação, a substituição associativa procede por um mecanismo similar ao SN2.
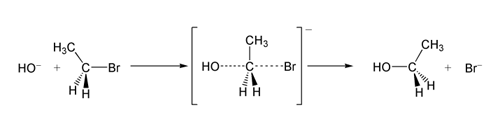
Reação SN2 do bromoetano com íon hidróxido.
Fatores que afetam o ritmo da reação
Quatro fatores afetam a taxa da reação:
- Substrato. O substrato desempenha o papel mais importante na determinação da taxa da reação. Isto porque o nucleófilo ataca pela parte de trás do substrato, quebrando assim a ligação do grupo que deixa o carbono e formando a ligação carbono-nucleofílica. Portanto, para maximizar a taxa da reação SN2, o dorso do substrato deve estar o mais livre possível. Em geral, isto significa que os substratos metilo e primário reagem mais rapidamente, seguidos pelos substratos secundários. Os substratos terciários não participam das reações SN2, por causa dos obstáculos estéreis.
- Nucleófilo. Assim como o substrato, o impedimento estéreo afeta a força do nucleófilo. O ânion metóxido, por exemplo, é tanto uma base forte quanto um nucleófilo porque é um nucleófilo de metila, e por isso é muito livre de obstáculos. O terc-butoxida, por outro lado, é uma base forte, mas um pobre nucleófilo, por causa de seus três grupos metilo que dificultam sua abordagem do carbono. A força nucleófila também é afetada pela carga e pela eletronegatividade: a nucleofilicidade aumenta com o aumento da carga negativa e a diminuição da eletronegatividade. Por exemplo, OH- é um melhor nucleófilo que a água, e I- é um melhor nucleófilo que Br- (em solventes proticos polares). Em um solvente polar prótico, a nucleofilicidade aumenta em uma coluna da tabela periódica, pois não há ligação de hidrogênio entre o solvente e o nucleófilo. Neste caso, a nucleofilicidade espelha a basicidade. I- seria, portanto, um nucleófilo mais fraco do que Br- porque é uma base mais fraca.
- Solvente. O solvente afeta a taxa de reação porque os solventes podem ou não cercar um nucleófilo, dificultando ou não sua aproximação ao átomo de carbono. Os solventes polares próticos, como o tetrahidrofurano, são melhores solventes para esta reação do que os solventes polares próticos porque os solventes polares próticos serão solvados pela ligação do solvente hidrogênio ao nucleófilo. Isto o impede de atacar o carbono com o grupo de saída.
- Deixando o grupo. O grupo de saída afeta a taxa de reação. Quanto mais estável for o grupo de saída, mais provável é que ele leve consigo os dois elétrons de seu grupo de saída de carbono quando o nucleófilo atacar o carbono. Portanto, quanto mais fraco for o grupo de saída como uma base conjugada, melhor será o grupo de saída. Da mesma forma, quanto mais forte for seu ácido correspondente, melhor será o grupo de saída. Exemplos de bons grupos de saída são os haleto (exceto o flúor) e tosilato. Mas HO- e H2N- não são bons grupos de saída.
Cinética de reação
A taxa de uma reação SN2 é de segunda ordem, pois a etapa determinante da taxa depende da concentração de nucleófilos, [Nu-] assim como a concentração de substrato, [RX].
r = k[RX][Nu-]
Esta é uma diferença chave entre os mecanismos SN1 e SN2. Na reação SN1, os ataques dos nucleófilos após a etapa de limitação da taxa terminam. Mas em uma reação SN2, o nucleófilo força o grupo de saída na etapa limitadora. Em outras palavras, a taxa de reações SN1 depende apenas da concentração do substrato enquanto a taxa de reação SN2 depende da concentração do substrato e do nucleófilo. Nos casos em que ambos os mecanismos são possíveis (por exemplo, em um centro secundário de carbono), o mecanismo depende do solvente, temperatura, concentração do nucleófilo ou do grupo de saída.
As reações SN2 são geralmente favorecidas nos halogenetos alquílicos primários ou secundários com um solvente aprox. Elas ocorrem a uma taxa insignificante nos halogenetos alquílicos terciários devido a um impedimento estéreo.
SN2 e SN1 são dois extremos de uma escala deslizante de reações. É possível encontrar muitas reações que exibem tanto SN2 quanto SN1 em seus mecanismos. Por exemplo, é possível obter um par de íons de contato formado a partir de um halogeneto alquílico no qual os íons não estão completamente separados. Quando estes sofrem substituição, a estereoquímica será invertida (como em SN2) para muitas das moléculas reagentes, mas algumas podem mostrar retenção de configuração. As reações SN2 são mais comuns do que as reações SN1.
Concurso E2
Uma reação lateral comum ocorrendo com reações SN2 é a eliminação do E2: o ânion que chega pode atuar como base e não como nucleófilo, removendo um próton e levando à formação do alqueno. Este efeito pode ser demonstrado na reação em fase gasosa entre um sulfonato e um brometo de alquilo simples que ocorre dentro de um espectrômetro de massa:

Com o brometo de etilo, o produto de reação é predominantemente o produto de substituição. À medida que aumenta o obstáculo estéreo em torno do centro eletrofílico, como no caso do brometo de isobutila, a substituição é desfavorecida e a eliminação é a reação predominante. Outros fatores que favorecem a eliminação são a força da base. Com o substrato menos básico de benzoato, o brometo de isopropil reage com 55% de substituição. Em geral, as reações de fase gasosa e de fase de solução deste tipo seguem as mesmas tendências, ainda que no primeiro, os efeitos do solvente sejam eliminados.
Mecanismo de rotunda
Um desenvolvimento que chamou a atenção em 2008 diz respeito a um mecanismo de rotunda SN2 observado em uma reação em fase gasosa entre íons cloreto e iodeto de metila com uma técnica especial chamada imagem de feixe molecular cruzado. Quando os íons cloreto têm velocidade suficiente, a energia dos íons iodeto resultantes após a colisão é muito menor do que o esperado, e é teorizado que a energia é perdida como resultado de uma rotunda completa do grupo metilo ao redor do átomo de iodo antes que o deslocamento real ocorra.
Páginas relacionadas
- Reação de substituição
- Reação SN1
Perguntas e Respostas
P: O que é a reação SN2?
R: A reação SN2 é uma reação de substituição em química orgânica, na qual um nucleófilo ataca um centro eletrofílico deficiente em elétrons, expulsando um grupo de saída e, em seguida, substituindo-o em uma única etapa.
P: Que tipo de reação de substituição é a reação SN2?
R: A reação SN2 é um tipo de reação de substituição nucleofílica.
P: Quantas espécies reagentes estão envolvidas na etapa lenta e determinante da taxa da reação SN2?
R: Duas espécies reagentes estão envolvidas na etapa lenta e determinante da reação SN2.
P: Qual é o significado do nome "substituição nucleofílica bimolecular" para a reação SN2?
R: O nome "substituição nucleofílica bimolecular" para a reação SN2 refere-se ao fato de que duas espécies reagentes estão envolvidas na etapa lenta e determinante da taxa da reação.
P: O que é um nucleófilo no contexto da reação SN2?
R: Um nucleófilo é uma molécula ou íon que doa um par solitário de elétrons para formar uma ligação química.
P: O que é um eletrófilo no contexto da reação SN2?
R: Um eletrófilo é uma molécula ou íon que aceita um par de elétrons para formar uma ligação química.
P: Como é conhecida a reação SN2 entre os químicos inorgânicos?
R: Entre os químicos inorgânicos, a reação SN2 é frequentemente conhecida como mecanismo de intercâmbio.
Pesquise na enciclopédia