Tabela periódica
A tabela periódica dos elementos químicos é uma lista de elementos químicos conhecidos. Na tabela, os elementos são colocados na ordem de seus números atômicos, começando com o menor número de um, hidrogênio. O número atômico de um elemento é o mesmo que o número de prótons naquele núcleo particular de um átomo. Na tabela periódica, os elementos são dispostos em períodos e grupos. Uma fileira de elementos ao longo da tabela é chamada de ponto. Cada período tem um número; de 1 a 8. O período 1 tem apenas 2 elementos: hidrogênio e hélio. O período 2 e o período 3 têm ambos 8 elementos. Os outros períodos são mais longos. Os elementos de um período têm números atômicos consecutivos.
Uma coluna de elementos abaixo da tabela é chamada de grupo. Há 18 grupos na tabela periódica padrão. Cada grupo tem um número: de 1 a 18. Os elementos de um grupo têm elétrons dispostos de maneira semelhante, de acordo com o número de elétrons de valência, o que lhes confere propriedades químicas semelhantes (eles se comportam de maneira semelhante). Por exemplo, o grupo 18 é conhecido como os gases nobres porque todos eles são gases e não se combinam com outros átomos.
Há dois sistemas de números de grupo; um usando números arábicos (1,2,3) e o outro usando números romanos (I, II, III). Os nomes dos numerais romanos foram usados na maior parte do século XX. Em 1990, a União Internacional de Química Pura e Aplicada (IUPAC) decidiu usar o novo sistema com numerais arábicos, para substituir os dois antigos sistemas de grupos que usavam numerais romanos.
A tabela periódica tem sido utilizada por químicos para observar padrões e relações entre os elementos. Há 3 grupos principais na Tabela Periódica; metais, metalóides e não-metálicos. Por exemplo, os elementos na parte inferior e na extrema esquerda da tabela são os mais metálicos, e os elementos na parte superior direita são os menos metálicos. (por exemplo, o césio é muito mais metálico do que o hélio). Há também muitos outros padrões e relações.
A tabela periódica foi inventada pelo químico russo Dmitry IvanovichMendeleyev (1834-1907). Em sua homenagem, o elemento 101 recebeu o seu nome, mendelevium.
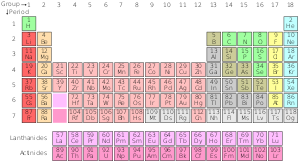
A variação padrão da tabela periódica
Tabela periódica padrão
| Grupo→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 12 | 13 | 14 | 15 | 16 | 17 | ||||
| 1 | 2 | |||||||||||||||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||||||||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | ||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | ||
| 6 | 55 | 56 | * Lanthanides | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | ||
| 7 | 87 Fr | 88 | ** Actinides | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | ||
| 8 | 119 Uue | 120 Ubn | *** Superactinídeas | |||||||||||||||||
| * Série Lanthanide | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |||||
| ** Série Actinide | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | |||||
| *** Série Superactinídea | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129Ube | 130Utn | 131Utu | 132Utb | 133Utt | 134Utq | 135Utp | |||||
| *** Série Superactinídea | 136Uth | 137Uts | 138Uto | 139Ute | 140Uqn | 141Uqu | 142Uqb | 143Uqt | 144Uqq | 145Uqp | 146Uqh | 147Uqs | 148Uqo | 149Uqe | 150Upn | |||||
| *** Série Superactinídea | 151Upu | 152Upb | 153Upt | 154Upq | 155Upp | 156Uph | 157Ups | 158Upo | 159Upe | 160Uhn | 161Uhu | 162Uhb | 163Uht | 164Uhq | 165Uhp | |||||
| *** Série Superactinídea | 166Uhh | 167Uhs | 168Uho | 169Uhe | 170Usn | 171Usu | 172Usb | 173Ust | 174Usq | 175Usp | 176Ush | 177Uss | 178Uso | 179Use | 180Uon | |||||
| *** Série Superactinídea | 181Uou | 182Uob | 183Uot | 184Uoq | 185Uop | 186Uoh | 187Uos | 188Uoo | 189Uoe | 190Uen | 191Ueu | 192Ueb | 193Uet | 194Ueq | 195Uep | |||||
| *** Série Superactinídea | 196Ueh | 197Ues | 198Ueo | 199Uee | 200Bnn | 201Bnu | 202Bnb | 203Bnt | 204Bnq | 205Bnp | 206Bnh | 207Bns | 208Bno | 209Bne | 210Bun | |||||
| *** Série Superactinídea | 211Buu | 212Bub | 213 Mas | 214Buq | 215Bup | 216Buh | 217Bus | 218Buo | 219Bue | 220Bbn | 221Bbu | 222Bbb | 223Bbt | 224Bbq | 225Bbp | |||||
Série Química da Tabela Periódica
- Metais alcalinos
- Terras alcalinas
- Lanthanides
- Actinides
- Superactinídeas
- Metais de transição
- Metais pobres
- Não-metálicos
- Halogênicos
Estado à temperatura e pressão padrão. A cor do número (número atômico) acima do símbolo do elemento mostra o estado do elemento em condições normais.
- os de azul são gases
- aqueles em verde são líquidos
- os de preto são sólidos
- Aqueles com bordas sólidas possuem isótopos estáveis (elementos primordiais)
- Aqueles com bordas tracejadas têm apenas isótopos radioativos naturais
- Aqueles com bordas pontilhadas não ocorrem naturalmente (Elementos Sintéticos)
- aqueles sem fronteiras são radioativos demais para terem sido descobertos ainda.
Outros métodos para a exibição dos elementos químicos
A versão da tabela periódica mostrada acima é a mais utilizada. Outras versões generalizadas são mostradas abaixo:
· 
Theodor Benfey organizou os elementos em uma espiral, em torno do hidrogênio. O peso atômico determina a posição do elemento.
· 
Dmitry Ivanovich Mendeleyev usou um arranjo floral; Actinides, Lanthanides são mostrados como loops ao lado do grupo principal.
· 
O Fogão Timothy organizou os elementos por número quântico.
· ![]()
Betterman organizou os elementos por suas propriedades isoelétricas, que podem ser convertidas para uma forma polinomial.
· 
Versão triangular, por Zmaczynski e Bayley
· 
Organizado em uma pirâmide.
Versões menos usadas
- A tabela padrão fornece o básico. Ela é mostrada acima
- Uma tabela vertical para melhorar a legibilidade em navegadores web
- A tabela grande fornece o básico mais os nomes completos dos elementos
- A enorme tabela fornece o básico mais os nomes completos dos elementos e as massas atômicas
- Configurações elétricas
- Metais e Não Metais
- Lista de elementos: inclui nome, símbolo, número atômico, massa atômica, grupo e período; classificável por qualquer um desses elementos
- Lista de elementos por símbolo
- Lista de elementos por ponto de ebulição
- Lista de elementos por ponto de fusão
- Lista de elementos por densidade
Páginas relacionadas
- Grupo de tabelas periódicas
- Período de tabela periódica
- Tabela periódica ampliada
Perguntas e Respostas
P: Qual é a tabela periódica?
R: A tabela periódica é um gráfico que organiza todos os elementos químicos conhecidos em ordem de seus números atômicos, começando com o hidrogênio no número um. Elementos com características semelhantes são freqüentemente colocados perto uns dos outros.
P: Quantos períodos e grupos existem na tabela periódica padrão?
R: Há 8 períodos e 18 grupos na tabela periódica padrão.
P: O que é que os elementos de um período têm em comum?
R: Os elementos de um período têm números atômicos consecutivos.
P: O que os elementos de um grupo têm em comum?
R: Os elementos de um grupo têm elétrons dispostos de maneira semelhante, de acordo com o número de elétrons de valência, o que lhes confere propriedades químicas semelhantes.
P: Quem inventou a tabela periódica?
R: Foi o químico russo Dmitry Ivanovich Mendeleyev quem inventou a tabela periódica (1834-1907).
P: Quais são os três grupos principais da Tabela Periódica?
R: Os três grupos principais da Mesa Periódica são: metais, metalóides e não metálicos.
P: Como podem ser observados os padrões e relações entre os elementos usando a Tabela Periódica?
R: Padrões e relações entre os elementos podem ser observados observando-se onde aparecem na Tabela Periódica; por exemplo, os elementos de baixo para a esquerda tendem a ser mais metálicos do que os de cima para a direita.
Pesquise na enciclopédia