Enzima
Enzimas são moléculas proteicas em células que funcionam como catalisadores biológicos. As enzimas aceleram as reações químicas no corpo, mas não são usadas no processo, portanto podem ser usadas repetidas vezes.
Quase todas as reações bioquímicas nos seres vivos precisam de enzimas. Com uma enzima, as reações químicas são muito mais rápidas do que seriam sem a enzima. p39 Outros biocatalisadores são moléculas catalíticas de RNA, chamadas ribozymes.
As substâncias no início de uma reação são chamadas de substratos. As substâncias no final de uma reação são os produtos. As enzimas trabalham sobre os substratos e os transformam em produtos. O estudo das enzimas é chamado de enzimologia.
A primeira enzima foi encontrada em 1833 por Anselme Payen.
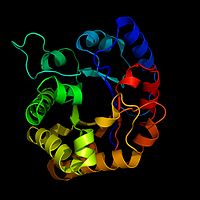
Diagrama de fita de uma enzima chamada TIM

Diagrama de fita de uma enzima chamada TIM
Estrutura enzimática
Existem milhares de enzimas diferentes e cada uma delas é específica para a reação que ela catalisa. As enzimas têm nomes que mostram o que elas fazem. Os nomes das enzimas geralmente terminam em - por exemplo, para mostrar que elas são enzimas. Exemplos disto incluem a ATP synthase. Ela faz um produto químico chamado ATP. Outro exemplo é a DNA polimerase. Ele lê uma fita de DNA intacta e a usa como modelo para fazer uma nova fita.Um exemplo de uma enzima é a amilase, encontrada na saliva. Ela decompõe as moléculas de amido em moléculas menores de glicose e maltose. Outro tipo de enzima é a lipase. Ela decompõe as gorduras em moléculas menores, ácidos graxos e glicerol.d
As proteases são uma classe inteira de enzimas. Elas decompõem outras enzimas e proteínas de volta em aminoácidos. As nucleases são enzimas que cortam o DNA ou RNA, muitas vezes em local específico na molécula.
Enzimas não são apenas para quebrar grandes produtos químicos em produtos químicos menores. Outras enzimas tomam produtos químicos menores e os transformam em produtos químicos maiores, e realizam muitas outras tarefas químicas. A classificação abaixo lista os principais tipos.
Os bioquímicos muitas vezes desenham uma imagem de uma enzima para usar como auxílio visual ou mapa da enzima. Isto é difícil de fazer porque pode haver centenas ou milhares de átomos em uma enzima. Os bioquímicos não podem desenhar todos esses detalhes. Em vez disso, eles usam modelos de fitas como imagens de enzimas. Os modelos de fitas podem mostrar a forma de uma enzima sem ter que desenhar cada átomo.
A maioria das enzimas não funcionará, a menos que a temperatura e o pH estejam corretos. Em mamíferos, a temperatura correta é geralmente de cerca de 37oC graus (temperatura corporal). O pH correto pode variar muito. A pepsina é um exemplo de uma enzima que funciona melhor quando o pH é de cerca de 1,5.
O aquecimento de uma enzima acima de uma certa temperatura destruirá a enzima permanentemente. Ela será decomposta por protease e os produtos químicos serão usados novamente.
Alguns produtos químicos podem ajudar uma enzima a fazer seu trabalho ainda melhor. Estes são chamados ativadores. Às vezes, um produto químico pode desacelerar uma enzima ou até mesmo fazer a enzima não funcionar em absoluto. Estes são chamados de inibidores. A maioria dos medicamentos são produtos químicos que ou aceleram ou retardam alguma enzima no corpo humano.
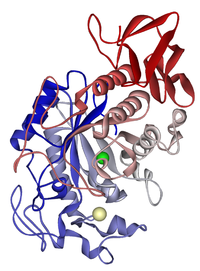
Amilase salivar: verde íon cloreto; bege cálcio
Estrutura enzimática
Existem milhares de enzimas diferentes e cada uma delas é específica para a reação que ela catalisa. As enzimas têm nomes que mostram o que elas fazem. Os nomes das enzimas geralmente terminam em - por exemplo, para mostrar que elas são enzimas. Exemplos disto incluem a ATP synthase. Ela faz um produto químico chamado ATP. Outro exemplo é a DNA polimerase. Ele lê uma fita de DNA intacta e a usa como modelo para fazer uma nova fita.Um exemplo de uma enzima é a amilase, encontrada na saliva. Ela decompõe as moléculas de amido em moléculas menores de glicose e maltose. Outro tipo de enzima é a lipase. Ela decompõe as gorduras em moléculas menores, ácidos graxos e glicerol.d
As proteases são uma classe inteira de enzimas. Elas decompõem outras enzimas e proteínas de volta em aminoácidos. As nucleases são enzimas que cortam o DNA ou RNA, muitas vezes em local específico na molécula.
Enzimas não são apenas para quebrar grandes produtos químicos em produtos químicos menores. Outras enzimas tomam produtos químicos menores e os transformam em produtos químicos maiores, e realizam muitas outras tarefas químicas. A classificação abaixo lista os principais tipos.
Os bioquímicos muitas vezes desenham uma imagem de uma enzima para usar como auxílio visual ou mapa da enzima. Isto é difícil de fazer porque pode haver centenas ou milhares de átomos em uma enzima. Os bioquímicos não podem desenhar todos esses detalhes. Em vez disso, eles usam modelos de fitas como imagens de enzimas. Os modelos de fitas podem mostrar a forma de uma enzima sem ter que desenhar cada átomo.
A maioria das enzimas não funcionará, a menos que a temperatura e o pH estejam corretos. Em mamíferos, a temperatura correta é geralmente de cerca de 37oC graus (temperatura corporal). O pH correto pode variar muito. A pepsina é um exemplo de uma enzima que funciona melhor quando o pH é de cerca de 1,5.
O aquecimento de uma enzima acima de uma certa temperatura destruirá a enzima permanentemente. Ela será decomposta por protease e os produtos químicos serão usados novamente.
Alguns produtos químicos podem ajudar uma enzima a fazer seu trabalho ainda melhor. Estes são chamados ativadores. Às vezes, um produto químico pode desacelerar uma enzima ou até mesmo fazer a enzima não funcionar em absoluto. Estes são chamados de inibidores. A maioria dos medicamentos são produtos químicos que ou aceleram ou retardam alguma enzima no corpo humano.

Amilase salivar: verde íon cloreto; bege cálcio
Modelo de fechadura e chave
As enzimas são muito específicas. Em 1894 Emil Fischer sugeriu que tanto a enzima quanto o substrato têm formas geométricas complementares específicas que se encaixam exatamente um no outro. Isto é freqüentemente referido como o modelo "a fechadura e a chave". Entretanto, este modelo não explica o que acontece a seguir.Em 1958, Daniel Koshland sugeriu uma modificação no modelo de fechadura e chave. Como as enzimas são estruturas bastante flexíveis, o local ativo é remodelado através de interações com o substrato. Como resultado, o substrato não se liga simplesmente a um local rígido e ativo. As cadeias laterais de aminoácidos do local ativo são dobradas em posições para que a enzima faça seu trabalho catalítico. Em alguns casos, como as glicosidases, a molécula do substrato também muda ligeiramente de forma ao entrar no local ativo.
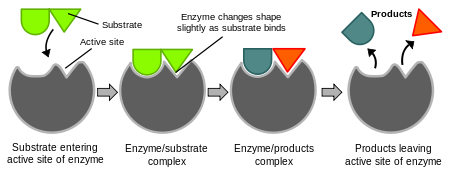
Diagramas para mostrar a hipótese de ajuste induzido de ação enzimática
Modelo de fechadura e chave
As enzimas são muito específicas. Em 1894 Emil Fischer sugeriu que tanto a enzima quanto o substrato têm formas geométricas complementares específicas que se encaixam exatamente um no outro. Isto é freqüentemente referido como o modelo "a fechadura e a chave". Entretanto, este modelo não explica o que acontece a seguir.Em 1958, Daniel Koshland sugeriu uma modificação no modelo de fechadura e chave. Como as enzimas são estruturas bastante flexíveis, o local ativo é remodelado através de interações com o substrato. Como resultado, o substrato não se liga simplesmente a um local rígido e ativo. As cadeias laterais de aminoácidos do local ativo são dobradas em posições para que a enzima faça seu trabalho catalítico. Em alguns casos, como as glicosidases, a molécula do substrato também muda ligeiramente de forma ao entrar no local ativo.

Diagramas para mostrar a hipótese de ajuste induzido de ação enzimática
Função
A equação geral para uma reação enzimática é:
Substrato + Enzima -> Substrato:Enzima -> Produto:Enzima -> Produto + Enzima
As enzimas reduzem a energia de ativação de uma reação ao formar um complexo intermediário com o substrato. Este complexo é chamado de complexo enzimático-substrato.
Por exemplo, a sucrase, 400 vezes o tamanho de seu substrato de sacarose, divide a sacarose em seus açúcares constituintes, que são a glicose e a frutose. A sucrase dobra a sacarose e estica a ligação entre a glicose e a frutose. As moléculas de água se unem e fazem a clivagem em uma fração de segundo. As enzimas têm estas características principais:
- Eles são catalíticos. Normalmente aumentam a taxa de reação 10 bilhões de vezes. p39 A própria enzima não é alterada pela reação.
- Eles são eficazes em pequenas quantidades. Uma molécula enzimática pode converter 1000 moléculas de substrato por minuto, e algumas são conhecidas por converterem 3 milhões em um minuto. p39
- Eles são altamente específicos. Uma enzima só realizará uma das muitas reações das quais um substrato é capaz.
Controle da atividade enzimática
Há cinco formas principais de controlar a atividade enzimática na célula.
- A produção enzimática (transcrição e tradução de genes enzimáticos) pode ser aumentada ou reduzida em resposta a mudanças no ambiente da célula. Esta forma de regulação gênica é chamada de indução e inibição enzimática. Por exemplo, em bactérias resistentes a antibióticos, como a penicilina, são induzidas enzimas que hidrolisam a molécula da penicilina.
- Enzimas podem ocorrer em diferentes compartimentos celulares. Por exemplo, os ácidosgraxos são sintetizados por um conjunto de enzimas no citosol, no retículo endoplasmático e no aparelho Golgi. Depois são usados por um conjunto diferente de enzimas como fonte de energia nas mitocôndrias.
- As enzimas podem ser reguladas por seus próprios produtos. Por exemplo, o(s) produto(s) final(is) muitas vezes inibe(m) uma das primeiras enzimas do caminho. Tal mecanismo regulador é chamado de feedback negativo, porque a quantidade do produto final produzido é regulada por sua própria concentração. Isto evita que as células façam enzimas em demasia. O controle da ação enzimática ajuda a manter um ambiente interno estável nos organismos vivos.
- As enzimas podem ser reguladas por serem modificadas após sua produção. Um exemplo é a clivagem da cadeia de polipéptidos. A quimotripsina, uma protease digestiva, é produzida de forma inativa no pâncreas e transportada nesta forma até o estômago, onde é ativada. Isto impede a enzima de digerir o pâncreas ou outros tecidos antes que ele entre no intestino. Este tipo de precursor inativo de uma enzima é conhecido como um zymogen.
- Algumas enzimas podem se tornar ativadas quando mudam para um ambiente diferente (por exemplo, de pH alto para pH baixo). Por exemplo, a hemaglutinina no vírus da gripe é ativada por uma mudança na forma. Isto é causado pelas condições ácidas que ocorrem dentro do lisossoma da célula hospedeira.
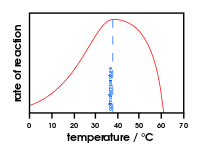
Gráfico mostrando o efeito da mudança de temperatura na atividade enzimática
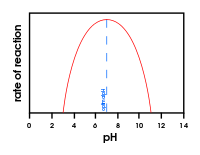
Gráfico mostrando o efeito da mudança do pH na atividade enzimática
Função
A equação geral para uma reação enzimática é:
Substrato + Enzima -> Substrato:Enzima -> Produto:Enzima -> Produto + Enzima
As enzimas reduzem a energia de ativação de uma reação ao formar um complexo intermediário com o substrato. Este complexo é chamado de complexo enzimático-substrato.
Por exemplo, a sucrase, 400 vezes o tamanho de seu substrato de sacarose, divide a sacarose em seus açúcares constituintes, que são a glicose e a frutose. A sucrase dobra a sacarose e estica a ligação entre a glicose e a frutose. As moléculas de água se unem e fazem a clivagem em uma fração de segundo. As enzimas têm estas características principais:
- Eles são catalíticos. Normalmente aumentam a taxa de reação 10 bilhões de vezes. p39 A própria enzima não é alterada pela reação.
- Eles são eficazes em pequenas quantidades. Uma molécula enzimática pode converter 1000 moléculas de substrato por minuto, e algumas são conhecidas por converterem 3 milhões em um minuto. p39
- Eles são altamente específicos. Uma enzima só realizará uma das muitas reações das quais um substrato é capaz.
Controle da atividade enzimática
Há cinco formas principais de controlar a atividade enzimática na célula.
- A produção enzimática (transcrição e tradução de genes enzimáticos) pode ser aumentada ou reduzida em resposta a mudanças no ambiente da célula. Esta forma de regulação gênica é chamada de indução e inibição enzimática. Por exemplo, em bactérias resistentes a antibióticos, como a penicilina, são induzidas enzimas que hidrolisam a molécula da penicilina.
- Enzimas podem ocorrer em diferentes compartimentos celulares. Por exemplo, os ácidos graxos são sintetizados por um conjunto de enzimas no citosol, no retículo endoplasmático e no aparelho Golgi. Depois são usados por um conjunto diferente de enzimas como fonte de energia nas mitocôndrias.
- As enzimas podem ser reguladas por seus próprios produtos. Por exemplo, o(s) produto(s) final(is) muitas vezes inibe(m) uma das primeiras enzimas do caminho. Tal mecanismo regulador é chamado de feedback negativo, porque a quantidade do produto final produzido é regulada por sua própria concentração. Isto evita que as células façam enzimas em demasia. O controle da ação enzimática ajuda a manter um ambiente interno estável nos organismos vivos.
- As enzimas podem ser reguladas por serem modificadas após sua produção. Um exemplo é a clivagem da cadeia de polipéptidos. A quimotripsina, uma protease digestiva, é produzida de forma inativa no pâncreas e transportada nesta forma até o estômago, onde é ativada. Isto impede a enzima de digerir o pâncreas ou outros tecidos antes que ele entre no intestino. Este tipo de precursor inativo de uma enzima é conhecido como um zymogen.
- Algumas enzimas podem se tornar ativadas quando mudam para um ambiente diferente (por exemplo, de pH alto para pH baixo). Por exemplo, a hemaglutinina no vírus da gripe é ativada por uma mudança na forma. Isto é causado pelas condições ácidas que ocorrem dentro do lisossoma da célula hospedeira.

Gráfico mostrando o efeito da mudança de temperatura na atividade enzimática

Gráfico mostrando o efeito da mudança do pH na atividade enzimática
Inibidores enzimáticos
Os inibidores podem ser usados para impedir a ligação de uma enzima a um substrato. Isto pode ser feito para desacelerar uma reação controlada pela enzima. Os inibidores se encaixam de forma solta ou parcial no local ativo da enzima. Isto evita ou retarda a formação de um complexo enzimático-substrato.
Inibidores enzimáticos
Os inibidores podem ser usados para impedir a ligação de uma enzima a um substrato. Isto pode ser feito para desacelerar uma reação controlada pela enzima. Os inibidores se encaixam de forma solta ou parcial no local ativo da enzima. Isto impede ou retarda a formação de um complexo enzimático-substrato.
Desnaturação
A desnaturação é a alteração irreversível do local ativo de uma enzima, causada por uma mudança extrema na temperatura ou no pH. Ela diminuirá a taxa de reação porque a molécula do substrato não será capaz de se encaixar no local ativo, portanto, os produtos não podem ser formados.
Desnaturação
A desnaturação é a alteração irreversível do local ativo de uma enzima, causada por uma mudança extrema na temperatura ou no pH. Ela diminuirá a taxa de reação porque a molécula do substrato não será capaz de se encaixar no local ativo, portanto, os produtos não podem ser formados.
Cofactores
Cofactores, ou coenzimas, são moléculas de ajuda que são necessárias para fazer uma enzima funcionar. Não são proteínas, e podem ser moléculas orgânicas ou inorgânicas. Ambos os tipos de moléculas às vezes contêm um íon metálico no centro, como Mg2+, Cu2+, Mn2+ ou aglomerados de enxofre de ferro. Isto porque tais íons podem atuar como doadores de elétrons, e isto é importante em muitas reações. A necessidade de enzimas para vários pequenos ajudantes é a razão básica pela qual os animais, incluindo nós mesmos, precisam de oligoelementos e vitaminas.
Cofactores
Cofactores, ou coenzimas, são moléculas de ajuda que são necessárias para fazer uma enzima funcionar. Não são proteínas, e podem ser moléculas orgânicas ou inorgânicas. Ambos os tipos de moléculas às vezes contêm um íon metálico no centro, como Mg2+, Cu2+, Mn2+ ou aglomerados de enxofre de ferro. Isto porque tais íons podem atuar como doadores de elétrons, e isto é importante em muitas reações. A necessidade de enzimas para vários pequenos ajudantes é a razão básica pela qual os animais, incluindo nós mesmos, precisam de oligoelementos e vitaminas.
Classificação
As enzimas foram classificadas pela União Internacional de Bioquímica. Sua Comissão de Enzimas agrupou todas as enzimas conhecidas em seis classes:
- Oxido-reductases: transferência catalítica de elétrons
- Transferências: mover o grupo funcional de uma molécula para outra
- Hidrolases: adicionar grupo -OH (hidroxila)
- Lyases: ligações químicas divididas, e muitas vezes adicionam dupla ligação ou estrutura de anel
- Isomerases: A -> B onde B é um isômero de A
- Ligas: unir duas moléculas grandes: Ab + C -> A-C + b
As enzimas individuais recebem um número de quatro dígitos que as classifica no banco de dados. p145
Classificação
As enzimas foram classificadas pela União Internacional de Bioquímica. Sua Comissão de Enzimas agrupou todas as enzimas conhecidas em seis classes:
- Oxido-reductases: transferência catalítica de elétrons
- Transferências: mover o grupo funcional de uma molécula para outra
- Hidrolases: adicionar grupo -OH (hidroxila)
- Lyases: ligações químicas divididas, e muitas vezes adicionam dupla ligação ou estrutura de anel
- Isomerases: A -> B onde B é um isômero de A
- Ligas: unir duas moléculas grandes: Ab + C -> A-C + b
As enzimas individuais recebem um número de quatro dígitos que as classifica no banco de dados. p145
Utilização de enzimas
As enzimas são utilizadas comercialmente para:
- fazer comida para bebês - pré-digestão de alimentos para bebês
- amolecimento dos centros de chocolates
- pó de lavagem biológico - que contém enzimas proteases para quebrar a sujeira e a sujeira. Ele quebra as moléculas grandes e insolúveis em moléculas pequenas e solúveis. Funciona a uma temperatura mais baixa, portanto, é necessária menos energia (termoestável).
Utilização de enzimas
As enzimas são utilizadas comercialmente para:
- fazer comida para bebês - pré-digestão de alimentos para bebês
- amolecimento dos centros de chocolates
- pó de lavagem biológico - que contém enzimas proteases para quebrar a sujeira e a sujeira. Ele quebra as moléculas grandes e insolúveis em moléculas pequenas e solúveis. Funciona a uma temperatura mais baixa, portanto, é necessária menos energia (termoestável).
Páginas relacionadas
- Cinética de ruptura
Páginas relacionadas
- Cinética de ruptura
Perguntas e Respostas
P: O que é uma enzima?
R: Uma enzima é uma molécula de proteína nas células que funciona como um catalisador biológico.
P: Qual é a função das enzimas no corpo?
R: As enzimas aceleram as reações químicas no corpo, mas não se esgotam no processo, de modo que podem ser usadas várias vezes.
P: Todas as reações bioquímicas nos seres vivos precisam de enzimas?
R: Sim, quase todas as reações bioquímicas nos seres vivos precisam de enzimas.
P: O que são substratos?
R: Substratos são as substâncias no início de uma reação.
P: O que são produtos?
R: Produtos são as substâncias no final de uma reação.
P: Como é chamado o estudo das enzimas?
R: O estudo das enzimas é chamado de enzimologia.
Q: Quem descobriu a primeira enzima?
R: A primeira enzima foi descoberta em 1833 por Anselme Payen.
Pesquise na enciclopédia